Nous expliquons ce qu’est la chaleur spécifique et quelles sont ses unités. Aussi, les formules utilisées pour le calculer et quelques exemples.
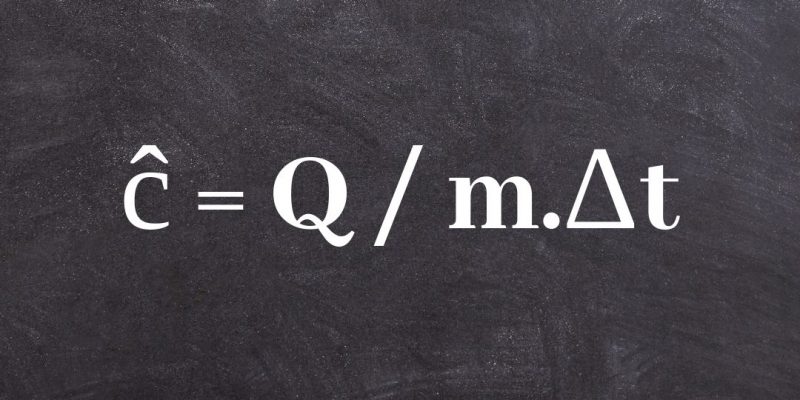
Qu’est-ce que la chaleur spécifique ?
En physique , la chaleur spécifique (également appelée capacité thermique spécifique ou capacité thermique spécifique) est comprise comme la quantité de chaleur nécessaire à une unité d’une substance pour augmenter sa température d’une unité de degré Celsius.
La chaleur spécifique varie selon l’état physique de la matière , c’est-à-dire qu’elle est différente si la matière est à l’état solide , liquide ou gazeux car sa structure moléculaire particulière affecte la transmission de la chaleur au sein du système de particules . Il en va de même pour les conditions de pression atmosphérique : plus la pression est élevée , plus la chaleur spécifique est faible.
Voir aussi: Propriétés de la matière
Unités thermiques spécifiques
Puisque dans le Système international de mesure l’unité de chaleur est le joule (J) , la chaleur spécifique est exprimée dans ce système en joules par kilogramme et par kelvin (J.Kg -1 .K -1 ).
Une autre forme courante de mesure implique l’utilisation de calories par gramme et par degré centigrade (cal.g -1 .°C -1 ), et dans les pays ou régions qui utilisent le système anglo-saxon, elle est mesurée en BTU par livre et par degré Fahrenheit. Ces deux derniers, hors SI.
Formules de chaleur spécifiques
La formule la plus courante pour calculer la chaleur spécifique d’une substance est :
ĉ = Q / m.Δt
où Q représente le transfert d’énergie thermique entre le système et son environnement, m la masse du système et Δt la variation de température à laquelle il est soumis.
Ainsi, la chaleur spécifique ( c ) à une température donnée ( T ) sera calculée comme suit :
c = lim (∆t→0) . Q / m.ΔT = 1/m. dQ/dT
Plus la chaleur spécifique d’une substance est élevée par rapport à un certain apport de chaleur, moins sa température variera. Par exemple, on préfère utiliser une cuillère de cuisine en bois et non en aluminium car la chaleur spécifique du bois est considérablement plus élevée que celle de l’aluminium.
Cela peut vous aider à : Transfert de chaleur
exemples de chaleur spécifique

Un exemple simple de chaleur spécifique est celui de l’eau . Une calorie est nécessaire pour élever d’un degré Celsius un gramme d’eau à température ambiante, c’est-à-dire que la chaleur spécifique de l’eau est de 1 cal.g -1 .° C -1 . En revanche, il faut 0,5 calorie pour élever d’un degré la température de la glace à -5°C.
L’eau est la substance commune avec la chaleur spécifique la plus élevée et joue donc un rôle très important dans la régulation de la température de la planète .
Les autres registres de chaleur spécifiques sont :
- Aluminium. 0,215 calories par gramme par degré Celsius
- cuivre . 0,0924 calories par gramme par degré Celsius
- Or. 0,0308 calories par gramme par degré Celsius
- Fer. 0,107 calories par gramme par degré Celsius
- Silicium. 0,168 calories par gramme par degré Celsius
- Potassium. 0,019 calories par gramme par degré Celsius
- Verre. 0,2 calories par gramme par degré Celsius
- Marbre. 0,21 calories par gramme par degré Celsius
- Bois. 0,41 calories par gramme par degré Celsius
- L’alcool éthylique. 0,58 calories par gramme par degré Celsius
- Mercure. 0,0033 calories par gramme par degré Celsius
- Huile d’olive. 0,47 calories par gramme par degré Celsius







