Nous expliquons quels sont les groupes du tableau périodique et les caractéristiques de chacun. Aussi, les périodes du tableau périodique.
Quels sont les groupes du tableau périodique ?
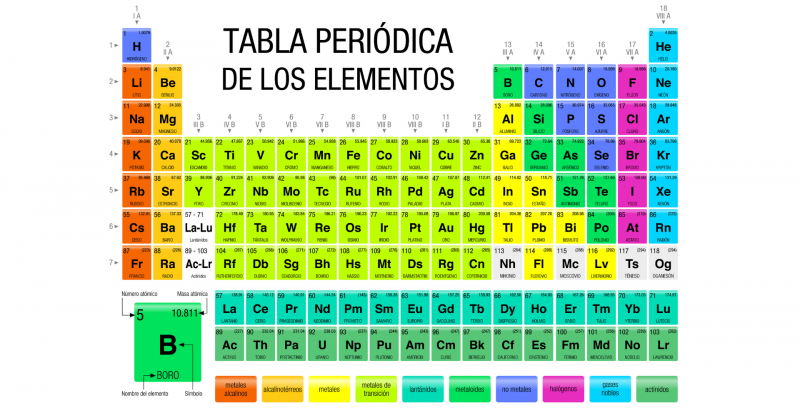
En chimie , les groupes du tableau périodique sont les colonnes d’éléments qui le composent , correspondant à des familles d’ éléments chimiques qui partagent bon nombre de leurs caractéristiques atomiques.
En fait, la fonction première du tableau périodique , créé par le chimiste russe Dmitri Mendeleyév (1834-1907), est précisément de servir de schéma de classement et d’organisation des différentes familles d’éléments chimiques connus, de sorte que les groupes ne forment qu’un. de ses composants les plus importants.
Ces groupes sont représentés dans les colonnes du tableau, tandis que les lignes constituent les périodes. Il existe 18 groupes différents, numérotés de 1 à 18, chacun regroupant un nombre variable d’éléments chimiques. Les éléments de chaque groupe ont le même nombre d’ électrons dans leur dernière couche atomique , c’est pourquoi ils ont des propriétés chimiques similaires, car les propriétés chimiques des éléments chimiques sont fortement liées aux électrons situés dans la dernière couche atomique.
La numérotation des différents groupes au sein du tableau est actuellement établie par l’Union Internationale de Chimie Pure et Appliquée (UICPA) et correspond aux chiffres arabes (1, 2, 3… 18), en substitution de la méthode européenne traditionnelle qui utilisait les chiffres romains. chiffres et lettres (IA, IIA, IIIA… VIIIA) et de la méthode américaine qui utilisait également des chiffres et des lettres romains, mais dans une autre disposition différente de la méthode européenne.
- UICPA. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18.
- système européen. IA, IIA, IIIA, IVA, VA, VIA, VIIA, VIIIA, VIIIA, VIIIA, IB, IIB, IIIB, IVB, VB, VIB, VIIB, VIIIB.
- système américain. IA, IIA, IIIB, IVB, VB, VIB, VIIB, VIIIB, VIIIB, VIIIB, IB, IIB, IIIA, IVA, VA, VIA, VIIA, VIIIA.
De cette façon, chaque élément présent dans le tableau périodique correspond toujours à un groupe et à une période spécifiques , qui reflètent la manière de classer la matière que l’humanité a développée scientifiquement.
Voir aussi : Numéro atomique
Quels sont les groupes du tableau périodique ?
Ensuite, nous décrirons chacun des groupes du tableau périodique en utilisant la numérotation IUPAC et l’ancien système européen :
- Groupe 1 (anciennement IA) ou métaux alcalins . Composé des éléments lithium (Li), sodium (Na), potassium (K), rubidium (Rb), césium (Ce) et francium (Fr), tous communs dans les cendres végétales et de nature basique lorsqu’ils font partie d’oxydes. Ils ont une faible densité , leur propre couleur et sont généralement doux. L’hydrogène (H) est également généralement inclus dans ce groupe, bien qu’il soit également courant qu’une position autonome parmi les éléments chimiques soit présente. Les métaux alcalins sont extrêmement réactifs et doivent être stockés dans l’huile pour les empêcher de réagir avec l’humidité de l’ air .. De plus, ils ne se trouvent jamais en tant qu’éléments libres, c’est-à-dire qu’ils font toujours partie d’un composé chimique .
- Groupe 2 (anciennement IIA) ou métaux alcalino-terreux. Composé des éléments béryllium (Be), magnésium (Mg), calcium (Ca), strontium (Sr), baryum (Ba) et radium (Ra). Le nom « alcalino-terreux » vient du nom que ses oxydes recevaient ( terres ). Ce sont des métaux mous (bien que plus durs que ceux du groupe 1), de faible densité, bons conducteurs et d’électronégativité inférieure ou égale à 1,57 selon l’échelle de Pauling (échelle établie pour organiser les valeurs d’électronégativité des atomes, où le fluor (F) est le plus électronégatif et le francium (Fr) est le moins électronégatif). Ce sont des éléments moins réactifs que ceux du groupe 1, mais malgré tout, ils restent très réactifs. Le dernier sur la liste (Ra) est radioactif et a une demi-vie très courte (le temps qu’il faut à un atome radioactif pour se désintégrer), il n’est donc souvent pas inclus dans les listes.
- Groupe 3 (anciennement IIIA) ou famille du scandium. Composé des éléments scandium (Sc), yttrium (Y), lanthane (La) et actinium (Ac), ou de lutétium (Lu) et de laurentium (Lr) (il y a un débat parmi les chercheurs pour savoir lequel de ces éléments devrait être inclus dans ce groupe). Ce sont des éléments solides et brillants, très réactifs et avec une grande tendance à l’oxydation , bons conducteurs de l’électricité .
- Groupe 4 (hors TVA) ou famille titane. Composé des éléments titane (Ti), zirconium (Zr), hafnium (Hf) et rutherfordium (Rf), qui sont des métaux très réactifs qui, lorsqu’ils sont exposés à l’air, prennent une couleur rouge et peuvent s’enflammer spontanément (c’est-à-dire qu’ils sont pyrophoriques ). Le dernier (Rf) de la famille est un élément synthétique et radioactif.
- Groupe 5 (anciennement VA) ou famille du vanadium. Composé des éléments vanadium (V), niobium (Nb), tantale (Ta) et dubnium (Db), des métaux qui ont 5 électrons dans leurs coquilles atomiques les plus externes. Le vanadium est assez réactif puisqu’il a une valence variable mais les autres le sont dans une très faible mesure, et le dernier (Db) est un élément synthétique qui n’existe pas dans la nature .
- Groupe 6 (anciennement VIA) ou famille chrome. Composé des éléments chrome (Cr), molybdène (Mo), tungstène (W) et seaborgium (Sg), tous les métaux de transition, et Cr, Mo et W sont réfractaires. Ils n’ont pas de caractéristiques électroniques uniformes, malgré leur comportement chimique similaire.
- Groupe 7 (anciennement VIIA) ou famille du manganèse. Composé des éléments manganèse (Mn), technétium (Tc), rhénium (Re) et bohrium (Bh), dont le premier (Mn) est très commun et les autres extrêmement rares, notamment le technétium (qui n’a pas d’isotopes stables) et rhénium (qui n’existe qu’à l’état de traces dans la nature).
- Groupe 8 (anciennement VIIIA) ou famille du fer. Composé des éléments fer (Fe), ruthénium (Ru), osmium (Os) et hassium (Hs), des métaux de transition qui ont huit électrons dans leur enveloppe externe. Le dernier de la liste (Hs) est un élément synthétique qui n’existe qu’en laboratoire.
- Groupe 9 (anciennement VIIIA) ou famille du cobalt. Composés des éléments cobalt (Co), rhodium (Rh), iridium (Ir), et meitnerium (Mr), ce sont des métaux de transition solides à température ambiante , dont le dernier (Mr) est synthétique et n’existe qu’en laboratoire.
- Groupe 10 (anciennement VIIIA) ou famille nickel . Composés des éléments nickel (Ni), palladium (Pd), platine (Pt) et darmstadtium (Ds), ce sont des métaux de transition solides à température ambiante, abondants dans la nature sous leur forme élémentaire, à l’exception du nickel qui a une énorme réactivité, il existe donc en formant des composés chimiques, et abonde également en météorites . Ils ont des propriétés catalytiques qui les rendent très importants dans l’ industrie chimique et dans l’ingénierie aérospatiale.
- Groupe 11 (anciennement IB) ou famille cuivre . Composé des éléments cuivre (Cu), argent (Ag), or (Au) et roentgenium (Rg), appelés « métaux monétaires » pour leur utilisation comme intrant pour les monnaies et les bijoux. L’or et l’argent sont des métaux précieux, tandis que le cuivre est très utile industriellement. La seule exception est le roentgenium, qui est synthétique et n’existe pas dans la nature. Ce sont de bons conducteurs électriques et l’argent a des niveaux extrêmement élevés de conduction thermique et de réflexion de la lumière . Ce sont des métaux très doux et ductiles, largement utilisés par l’humanité.
- Groupe 12 (anciennement IIB) ou famille du zinc. Composé des éléments zinc (Zn), cadmium (Cd) et mercure (Hg), bien que différentes expériences avec l’élément synthétique copernicium (Cn) pourraient l’inclure dans le groupe. Les trois premiers (Zn, Cd, Hg) sont abondamment présents dans la nature, et les deux premiers (Zn, Cd) sont des métaux solides, et le mercure est le seul métal liquide à température ambiante. Le zinc est un élément important pour le métabolisme des êtres vivants , tandis que les autres sont hautement toxiques .
- Groupe 13 (anciennement IIIB) ou famille du bore. Composés des éléments bore (B), aluminium (Al), gallium (Ga), indium (In), thallium (Tl) et nihonium (Nh), ils sont aussi appelés « terre » car ils sont très abondants dans la croûte terrestre . , à l’exception du dernier de la liste, de nature synthétique et inexistante. La popularité industrielle de l’aluminium a conduit le groupe à être également connu sous le nom de « groupe de l’aluminium ». Ces éléments ont trois électrons dans leur enveloppe externe, ce sont des métaux à très bas point de fusion , à l’exception du bore qui a un point de fusion très élevé et qui est un métalloïde .
- Groupe 14 (avant IVB) ou carbonoïdes. Composés des éléments carbone (C), silicium (Si), germanium (Ge), étain (Sn), plomb (Pb) et flerovium (Fl), ce sont pour la plupart des éléments bien connus et abondants, notamment le carbone, central pour la chimie des êtres vivants. Cet élément est non métallique , mais au fur et à mesure que vous descendez dans le groupe, les éléments deviennent de plus en plus métalliques, jusqu’à ce que vous atteigniez le plomb. Ce sont aussi des éléments largement utilisés dans l’industrie et très abondants dans la croûte terrestre (le silicium en constitue 28 %) à l’exception du flerovium, synthétique et radioactif à très courte demi-vie.
- Groupe 15 (avant VB) ou azotés. Composés des éléments azote (N), phosphore (P), arsenic (As), antimoine (Sb), bismuth (Bi) et l’élément synthétique Moscovium (Mc), ils sont aussi appelés pnicogènes, ils sont très abondants et très réactif étant à haute température. Ils ont cinq électrons dans leur enveloppe externe et, comme dans le groupe précédent, ils acquièrent des propriétés métalliques à mesure que nous progressons dans le groupe.
- Groupe 16 (anciennement VIB) ou chalcogènes ou anphigènes. Composés des éléments oxygène (O), soufre (S), sélénium (Se), tellure (Te), polonium (Po) et livermorium (Lv), ils sont, à l’exception du dernier (Lv, synthétique), très éléments communs utilisés industriellement. , les deux premiers (O, S) interviennent également dans les processus typiques de la biochimie . Ils ont six électrons dans leur enveloppe atomique externe et certains d’entre eux ont tendance à former des composés acides ou basiques , d’où leur nom d’amphigènes (du grec amphi- , « des deux côtés », et genos , « produire »). Parmi le groupe, l’oxygène se distingue, avec une très petite taille et une énorme réactivité.
- Groupe 17 (anciennement VIIB) ou halogènes. Composés des éléments fluor (F), chlore (Cl), brome (Br), iode (I), astatine (At) et ténésium (Ts), ils se trouvent généralement à l’état naturel sous forme de molécules diatomiques qui ont tendance à former des mononégatifs. ions appelés halogénures. . Le dernier de la liste (les T) est cependant synthétique et n’existe pas dans la nature. Ce sont des éléments abondants en biochimie, au pouvoir d’oxydation énorme (surtout le fluor). Son nom vient des mots grecs halos (« sel ») et genos (« produire »), c’est-à-dire « producteurs de sels ».
- Groupe 18 (anciennement VIIIB) ou gaz nobles . Composé des éléments hélium (He), néon (Ne), argon (Ar), krypton (Kr), xénon (Xe), radon (Rn) et oganesson (Og), son nom vient du fait que dans la nature ils tendent être sous forme gazeuse et avoir une très faible réactivité, ce qui en fait d’excellents isolants pour différentes industries. Ils ont des points de fusion et d’ ébullition très proches , ils ne peuvent donc être liquides que sur une petite plage de températures, et à l’exception du radon (hautement radioactif) et de l’oganesson (synthétique), ils sont abondants dans l’air terrestre et dans l’ univers (en particulier l’hélium, produit au cœur des étoiles par fusion d’hydrogène).
Périodes du tableau périodique
Tout comme il existe des groupes, représentés sous forme de colonnes, il existe également des périodes qui sont des lignes horizontales du tableau périodique . Les périodes sont directement liées aux niveaux d’ énergie de chaque élément, c’est-à-dire au nombre d’orbites électroniques qui entourent le noyau.
Par exemple, le fer (Fe) est dans la quatrième période , c’est-à-dire la quatrième ligne du tableau, puisqu’il possède quatre coques électroniques ; tandis que le baryum (Ba), ayant six couches, est dans la sixième période, c’est-à-dire la sixième ligne du tableau périodique.
Continuer avec : Formule chimique