Nous expliquons ce qu’est un ion et comment il se constitue et quelques exemples. Aussi, qu’est-ce qu’un anion et un cation.
Qu’est-ce qu’un ion ?
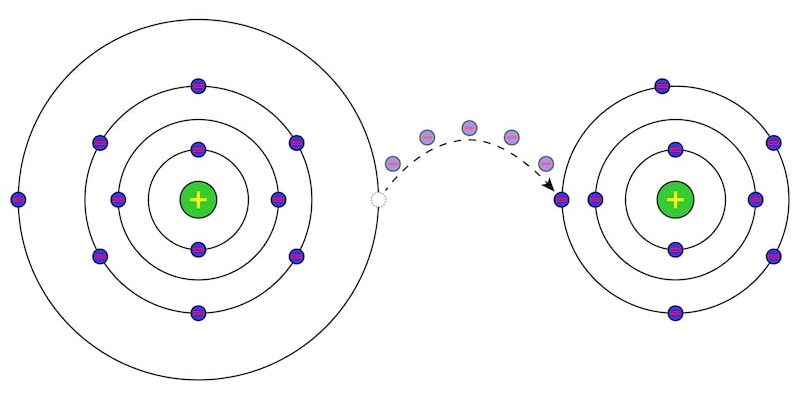
En chimie , une particule électriquement chargée est connue sous le nom d’ion et est constituée d’un atome ou d’une molécule qui n’est pas électriquement neutre, c’est-à-dire qui, dans sa constitution, a gagné ou perdu des électrons . Le processus par lequel les ions sont produits est appelé « ionisation ».
Les ions peuvent être constitués de deux ou plusieurs atomes (polyatomique) de nature différente, ou d’un seul atome (monatomique). Dans tous les cas, on parlera de cation (ou de cations) dans le cas d’un ion chargé positivement (c’est-à-dire que l’atome ou la molécule neutre initial a cédé des électrons), et on parlera d’ anion (ou d’anions ) dans le cas d’un ion chargé négativement (ce qui signifie que l’atome ou la molécule neutre initial a accepté des électrons).
D’autres types d’ions sont également connus, en fonction de leur charge électrique , appelés dianions (lorsqu’ils ont deux charges négatives), zwitterions (lorsqu’ils ont une charge positive et une charge négative isolées, mais dans le même composé, à cause de quoi est neutre), ou des radicaux ioniques (ions d’une réactivité et d’une instabilité énormes du fait qu’ils possèdent des électrons libres). En général, les ions sont très réactifs et ont tendance à se combiner avec d’autres ions, atomes ou molécules par interactions électrostatiques.
Les ions jouent un rôle essentiel dans la vie, notamment ceux du calcium, du potassium et du sodium , dont l’importance dans le transit des membranes cellulaires et dans les neurotransmetteurs a été largement étudiée. De plus, la compréhension des ions nous a permis de développer la technologie du plasma et même de mesurer la qualité de l’eau en fonction des sels ioniques qui y sont dissous.
Voir aussi: Liaison chimique
Anion
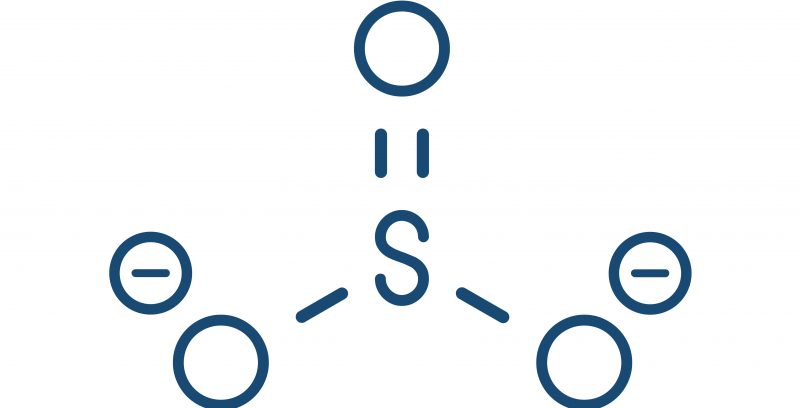
Les anions (ou anions) sont connus comme des ions qui ont une charge électrique négative , c’est-à-dire qu’ils ont gagné des électrons lors d’une réaction chimique qui les a engendrés. Ils peuvent être constitués d’un ou plusieurs atomes, mais même dans ce dernier cas, la charge globale de la molécule (son état d’oxydation ) est toujours négative.
Il existe trois types d’anions :
- Monatomique. Celles constituées d’un seul atome qui a gagné des électrons. Par exemple : Chlorure (Cl – ).
- Polyatomique. Ils proviennent d’une molécule qui a gagné des électrons lors d’une réaction chimique ou d’un acide qui a perdu des protons . Par exemple : Sulfite (SO 3 2- ).
- Acides . Ils proviennent d’un acide polyprotique (qui possède plusieurs hydrogènes ionisables) dont les protons ont été éliminés. Par exemple : Phosphate dihydrogène (H 2 PO 4 – ).
Cation
Les cations sont des ions qui ont une charge électrique positive , c’est-à-dire qu’ils ont perdu un ou plusieurs électrons. Ainsi, comme les anions, les cations peuvent également être composés d’un ou plusieurs atomes, tant que la charge totale du composé, dans ce cas, est positive.
L’une des fonctions les plus importantes des cations est leur participation aux processus biologiques . Par exemple, les cations Na + et K + jouent un rôle critique dans la transmission de l’influx nerveux.
exemples d’ions

Les ions les plus connus sont :
- cations simples. Composé d’un seul atome chargé positivement :
- Aluminium (Al 3+ )
- Césium (Cs + )
- Chrome (III) ou ion chromique (Cr 3+ )
- Chrome (VI) ou ion perchromique (Cr 6+ )
- Hydrogène ou proton (H + )
- Hélium ou particule alpha (He 2+ )
- Lithium (Li + )
- Fer (II) ou ion ferreux (Fe 2+ )
- Fer (III) ou ion ferrique (Fe 3+ )
- Nickel (III) ou ion nickelique (Ni 3+ )
- Étain (II) ou ion stanneux (Sn 2+ )
- Étain (IV) ou ion stannique (Sn 4+ )
- cations polyatomiques. Composé de deux ou plusieurs atomes chargés positivement :
- Ammonium (NH 4 + )
- Oxonium (H 3 O + )
- Nitronium (NO 2 + )
- Mercure (I) ou ion mercureux (Hg 2 2+ )
- anions simples. Composé d’un seul atome chargé négativement :
- Azide (N 3 – )
- Bromure (Br – )
- Carbure ( C4- )
- Chlorure (Cl – )
- Fluorure (F – )
- Phosphure (P 3- )
- Nitrure (N 3- )
- Sulfure (S 2- )
- Oxoanions. Composés d’oxygène et d’autres éléments, ils ont une charge négative :
- Arséniate (AsO 4 3- )
- Borate (BO 3 3- )
- Hypobromite (BrO – )
- Bicarbonate (HCO 3 – )
- Chlorate (ClO 3 – )
- Chlorite (ClO 2 – )
- Hypochlorite (ClO – )
- Bichromate (Cr 2 O 7 2- )
- Hydrogénosulfate ou bisulfate (HSO 4 – )
- Sulfite ou bisulfite d’hydrogène (HSO 3 – )
- Silicate (SiO 4 4- )
- Anions acides organiques. Issus de molécules organiques, ils ont une charge négative :
- Acétate (C 2 H 3 O 2 – )
- Oxalate (C 2 O 4 2- )
- Bioxalate (HC 2 O 4 – )
- d’autres anions. Avec une charge négative et plus d’un atome :
- Disulfure (HS – )
- Amide (NH 2 – )
- Cyanate (OCN – )
- Thiocyanate ( SCN- )
- Cyanure (CN – )
- Hydroxyde ( OH- )