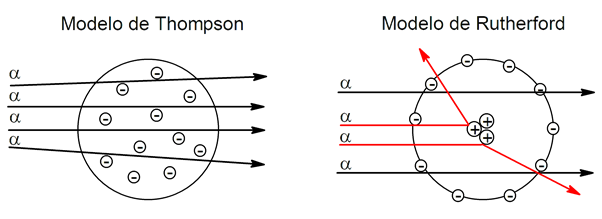Nous expliquons ce qu’est le modèle atomique de Rutherford et ses principaux postulats. Aussi, comment était l’expérience de Rutherford.
Quel est le modèle atomique de Rutherford ?
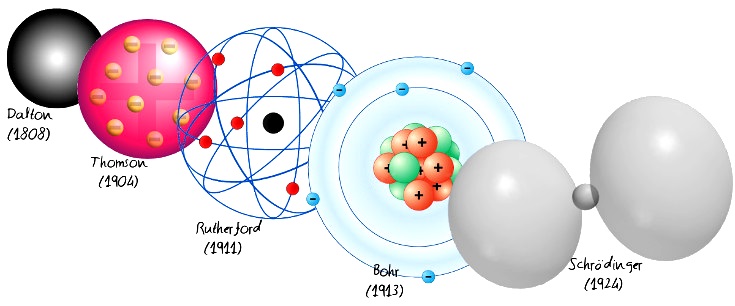
Le modèle atomique de Rutherford, comme son nom l’indique, était l’un des modèles proposés pour expliquer la structure interne de l’ atome . En 1911, le chimiste et physicien britannique Ernest Rutherford a proposé ce modèle basé sur les résultats de son expérimentation avec une feuille d’or.
Ce modèle constituait une rupture avec les modèles précédents tels que le Dalton Atomic Model et le Thompson Atomic Model, et un pas en avant par rapport au modèle actuellement accepté.
Dans son modèle atomique , Rutherford a proposé que les atomes aient un noyau central où se trouve le plus grand pourcentage de leur masse . De plus, selon cette théorie, ce noyau a une charge électrique positive et est mis en orbite par des particules de charge opposée et de plus petite taille (électrons).
Selon ses considérations, l’atome fonctionnait comme un système solaire d’électrons orbitant autour d’un noyau atomique plus lourd, comme le font les planètes autour du Soleil.
Le modèle atomique de Rutherford peut être résumé dans les trois propositions suivantes :
- La majeure partie de la masse atomique est concentrée dans le noyau, plus gros et plus lourd que le reste des particules , et doté d’une charge électrique positive.
- Autour du noyau et à de grandes distances de celui-ci se trouvent des électrons , avec une charge électrique négative, qui orbitent autour de lui selon des trajectoires circulaires.
- La somme des charges électriques positives et négatives d’un atome doit donner zéro, c’est-à-dire qu’elles doivent être égales, pour que l’atome soit électriquement neutre.
Rutherford a non seulement proposé cette structure pour l’atome, mais a également calculé sa taille et l’a comparée à la taille du noyau, concluant qu’une grande partie de la composition de l’atome est de l’espace vide .
Ce modèle, en revanche, présente certaines limites qui pourraient être résolues avec l’avancement des connaissances et de la technologie :
- Il n’était pas possible d’expliquer comment il était possible qu’un ensemble de charges positives reste unie dans le noyau atomique, puisqu’elles devaient se repousser, puisque ce sont toutes des charges de même signe.
- La stabilité de l’atome n’a pas pu être expliquée, car si l’on considère les électrons chargés négativement qui tournent autour du noyau positif, à un moment donné, ces électrons doivent perdre de l’énergie et s’effondrer contre le noyau.
Le modèle atomique de Rutherford était en vigueur pendant une courte période et a été remplacé par le modèle atomique proposé par le physicien danois Niels Bohr en 1913, dans lequel certaines des limitations ont été résolues et les propositions théoriques développées par Albert Einstein en 1905 ont été incorporées.
Voir aussi : Protons
L’expérience de Rutherford
La méthode expérimentale de Rutherford a commencé avec plusieurs fines feuilles d’or qui seraient bombardées en laboratoire avec des noyaux d’hélium (particules alpha, qui ont une charge positive), mesurant ainsi les angles de déviation du faisceau de particules lorsqu’il traversait l’or.
Ce comportement, qui atteignait parfois des déviations allant jusqu’à 90°, ne s’accordait pas avec le modèle atomique proposé par Thompson, qui prévalait à l’époque.
Le modèle de Thompson propose que l’atome soit une sphère positive , avec les électrons chargés négativement intégrés dedans. Pour cette raison, le modèle ressemble à un pudding avec des raisins secs : le pudding serait l’atome et les raisins secs seraient les électrons.
D’autre part, le modèle de Rutherford stipule que l’atome a la charge positive concentrée dans le noyau et que les électrons orbitent autour de lui. Si l’atome avait la structure proposée par Thompson, les particules alpha (positives), en traversant la feuille d’or, devraient suivre leurs trajectoires ou s’en écarter très peu. Cependant, ce qui s’est passé, c’est que des déviations de ces particules allant jusqu’à 90 et 180° ont été observées, ce qui a montré que l’atome, en effet, a la charge positive concentrée en son centre (comme l’a proposé Rutherford) et non distribuée dans une sphère. proposé par Thompson).