Nous expliquons ce qu’est une liaison chimique et comment elles sont classées. Exemples de liaisons covalentes, de liaisons ioniques et de liaisons métalliques.
Qu’est-ce qu’une liaison chimique ?
Une liaison chimique est la force qui relie les atomes pour former des composés chimiques . Cette union confère une stabilité au composé résultant. L’énergie nécessaire pour rompre une liaison chimique est appelée énergie de liaison.
Dans ce processus , les atomes cèdent ou partagent des électrons de la couche de valence (la couche externe d’un atome où sa réactivité ou sa tendance à former des liaisons est déterminée), et se réunissent pour former de nouvelles substances homogènes (pas des mélanges ), inséparables par mécanismes physiques tels que le filtrage ou le tamisage .
C’est un fait que les atomes qui composent la matière ont tendance à se réunir par diverses méthodes qui équilibrent ou partagent leurs charges électriques naturelles pour atteindre des conditions plus stables que lorsqu’ils sont séparés. Les liaisons chimiques constituent la formation de molécules organiques et inorganiques et, par conséquent, font partie de la base de l’existence des organismes vivants. De même, les liaisons chimiques peuvent être rompues sous certaines conditions .
Cela peut se produire en soumettant des composés chimiques à des températures élevées , en appliquant de l’électricité ou en favorisant des réactions chimiques avec d’autres composés. Par exemple, si nous appliquons de l’électricité à l’eau, il est possible de séparer les liaisons chimiques entre l’hydrogène et l’oxygène qui la composent, ce processus s’appelle l’électrolyse. Un autre exemple consiste à ajouter de grandes quantités d’ énergie thermique à une protéine , ce qui conduirait à la dénaturer (perdre la structure secondaire d’une protéine) ou à rompre ses liaisons.
Voir aussi: Modèles atomiques
Types de liaison chimique
Il existe trois types de liaison chimique connus, selon la nature des atomes impliqués :
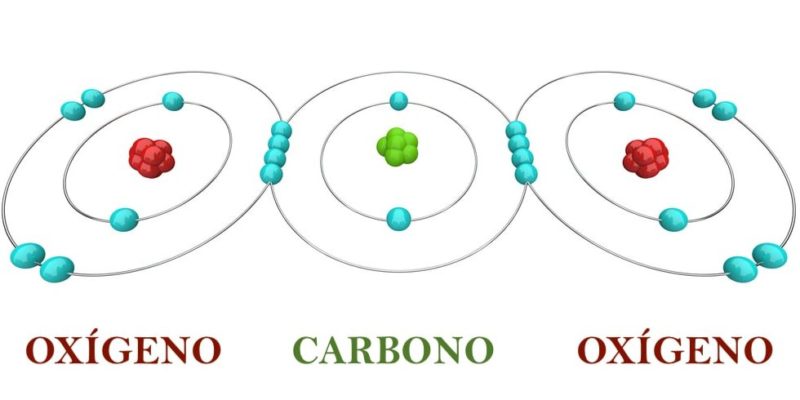
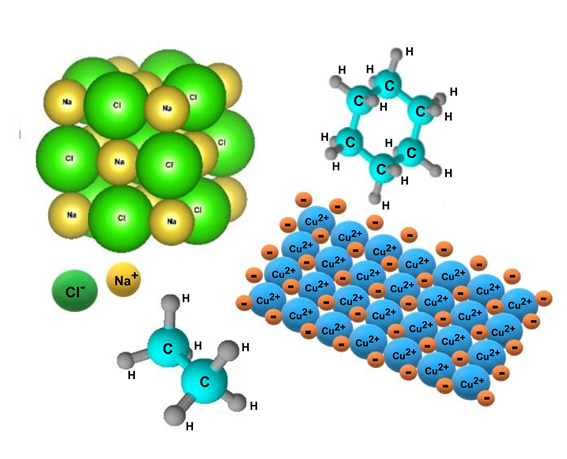
- liaison covalente . Il se produit entre des atomes non métalliques et ceux ayant des charges électromagnétiques similaires (généralement élevées), qui se rejoignent et partagent certaines paires d’électrons dans leur couche de valence. C’est le type de liaison prédominant dans les molécules organiques et peut être de trois types : simple (AA), double (A=A) et triple (A≡A), selon le nombre d’électrons partagés.
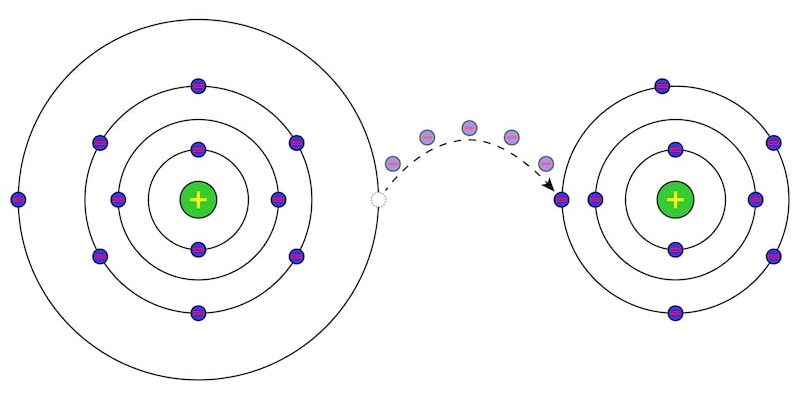
- liaison ionique . Il consiste en l’attraction électrostatique entre des particules avec des charges électriques de signes opposés appelées ions (particule chargée électriquement, qui peut être un atome ou une molécule qui a perdu ou gagné des électrons , c’est-à-dire qu’elle n’est pas neutre).
- liaison métallique . Elle ne se produit qu’entre atomes métalliques d’un même élément, qui constituent généralement des structures solides, extrêmement compactes. C’est une liaison forte, reliant les noyaux atomiques les uns aux autres, entourés de leurs électrons comme dans un nuage.
exemples de liaisons chimiques
Quelques exemples de composés à liaison covalente :
- Benzène ( C6H6 ) _
- Méthane (CH4 )
- Glucose ( C6H12O6 ) _ _ _
- Ammoniac ( NH3 )
- Fréon (CFC)
- Sous toutes les formes de carbone (C) : charbon, diamants, graphène, etc.
Quelques exemples de composés à liaison ionique :
- Oxyde de Magnésium (MgO)
- Sulfate de cuivre (CuSO 4 )
- Iodure de potassium (KI)
- Chlorure de manganèse (MnCl 2 )
- Carbonate de calcium (CaCO 3 )
- Sulfure de fer (Fe 2 S 3 )
Quelques exemples de composés à liaisons métalliques :
- Barres de fer (Fe)
- Dépôts de cuivre (Cu)
- Lingots d’or pur (Au)
- Lingots d’argent pur (Ag)