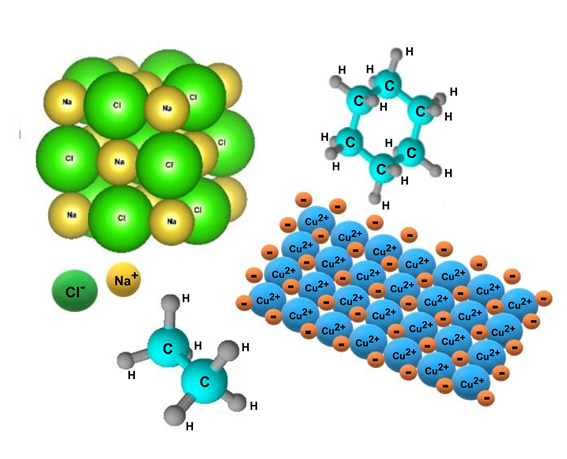
Nous expliquons ce qu’est une liaison ionique et ses propriétés. Exemples et applications de composés formés avec ce type de liaisons.
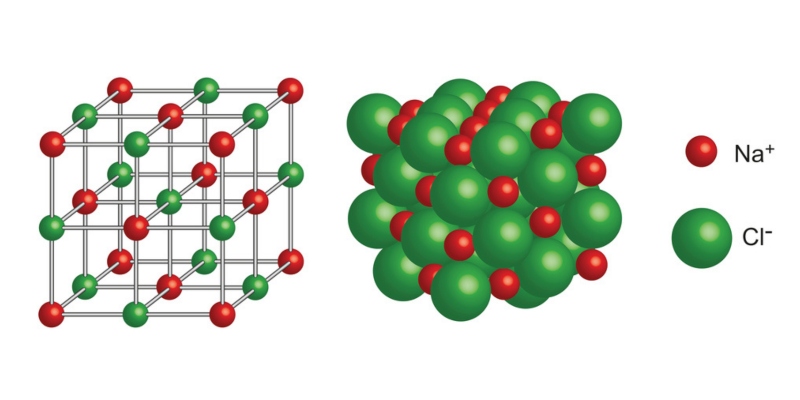
Qu’est-ce qu’une liaison ionique ?
La liaison ionique ou électrovalente consiste en l’attraction électrostatique entre des particules de charges électriques de signes opposés appelées ions .
Un ion est une particule chargée électriquement . Il peut s’agir d’un atome ou d’une molécule qui a perdu ou gagné des électrons , c’est-à-dire qu’il n’est pas neutre.
Ce type de liaison se manifeste généralement entre des atomes métalliques et non métalliques dans lesquels le transfert d’électrons se produit des atomes métalliques (moins électronégatifs) vers les atomes non métalliques (plus électronégatifs).
Pour qu’une liaison ionique se forme, il faut que la différence d’électronégativité (capacité d’un atome à attirer les électrons d’un autre atome lorsqu’ils se combinent dans une liaison chimique ) entre les deux types d’atomes soit supérieure ou égale à 1,7 sur l’échelle de Pauling, utilisé pour classer les atomes selon leurs valeurs d’électronégativité.
Bien que la liaison ionique se distingue généralement de la liaison covalente (consistant à partager des paires électroniques de la coque externe ou de valence des deux atomes), en réalité il n’y a pas de liaison ionique pure, mais ce modèle consiste en une exagération de la liaison covalente , utile pour l’étude du comportement atomique dans ces cas. Il y a toujours une certaine marge de covalence à ces jonctions.
Cependant, contrairement aux atomes qui forment les liaisons covalentes qui constituent souvent des molécules polaires, les ions n’ont pas de pôle positif et négatif, mais sont entièrement dominés par une seule charge . Ainsi, nous aurons des cations lorsqu’un atome perd des électrons (devient chargé positivement) et des anions lorsqu’un atome gagne des électrons (devient chargé négativement).
Cela peut fonctionner pour vous : liaison métallique
Propriétés des composés ioniques
Quelques caractéristiques générales d’un composé ionique :
- Ce sont des liens forts. La force de cette liaison atomique peut être très forte, de sorte que la structure de ces composés a tendance à former des réseaux cristallins très solides.
- Ils sont généralement solides. Aux températures et plages de pression normales (T = 25 ° C et P = 1 atm), ces composés ont une structure moléculaire cubique et rigide, qui forme des réseaux cristallins à l’origine de sels. Il existe également des liquides ioniques appelés « sels fondus », qui sont rares mais extrêmement utiles.
- Ils ont un point de fusion et d’ébullition élevé. Le point de fusion (entre 300 ºC et 1000 ºC) et le point d’ ébullition de ces composés sont généralement très élevés, car de grandes quantités d’ énergie sont nécessaires pour briser l’attraction électrostatique entre les ions.
- Solubilité dans l’eau. La plupart des sels sont solubles dans l’eau et d’autres solutions aqueuses qui ont un dipôle électrique (pôles positif et négatif).
- conduite électrique. A l’état solide, ils ne sont pas de bons conducteurs de l’électricité, car les ions occupent des positions très fixes dans un réseau cristallin. En revanche, une fois dissous dans l’eau ou dans une solution aqueuse, ils deviennent des conducteurs efficaces de l’électricité .
- Sélectivité. Les liaisons ioniques ne peuvent se produire qu’entre les métaux des groupes IA et IIA du tableau périodique des éléments et les non-métaux des groupes VIA et VIIA.
exemples de liaison ionique
- Fluorures (F – ). Anions faisant partie des sels obtenus à partir de l’acide fluorhydrique (HF). Ils sont utilisés dans la fabrication de dentifrices et autres fournitures dentaires.
Exemples : NaF, KF, LiF, CaF 2
- Sulfates (SO 4 2- ). Anions faisant partie des sels ou des esters obtenus à partir de l’acide sulfurique (H 2 SO 4 ), dont l’union avec un métal a diverses applications, des additifs pour l’obtention de matériaux de construction aux intrants pour la radiographie de contraste.
Exemples : CuSO 4 , CaSO 4 , K 2 SO 4
- Nitrates (NO 3 – ). Anions faisant partie des sels ou des esters obtenus à partir de l’acide nitrique (HNO 3 ), utilisés dans la fabrication de la poudre à canon et dans de nombreuses formulations chimiques pour les engrais.
Exemples : AgNO 3 , KNO 3 , Mg(NO 3 ) 2
- Mercure II (Hg 2+ ). Cation obtenu à partir du mercure, également appelé cation mercurique et qui n’est stable que dans des milieux à pH acide (<2). Les composés du mercure sont toxiques pour le corps humain, ils doivent donc être manipulés avec certaines précautions.
Exemples : HgCl 2 , HgCN 2
- Permanganates (MnO 4 – ). Les sels d’acide permanganique (HMnO 4 ) ont une couleur pourpre intense et un énorme pouvoir oxydant. Ces propriétés peuvent être utilisées dans la synthèse de la saccharine, dans le traitement des eaux usées et dans la fabrication de désinfectants.
Exemples : KMnO 4 , Ca(MnO 4 ) 2