Nous expliquons ce qu’est la loi de conservation de la matière ou loi de Lomonossov-Lavoisier. Histoire, contexte et exemples.

Loi de conservation de la matière
La loi de conservation de la matière , également connue sous le nom de loi de conservation de la masse ou simplement loi de Lomonosov-Lavoisier (en l’honneur des scientifiques qui l’ont postulée), est un principe de chimie qui stipule que la matière n’est ni créée ni n’est détruit lors d’une réaction chimique , il ne fait que se transformer.
Cela signifie que les quantités de masses impliquées dans une réaction donnée doivent être constantes, c’est-à-dire que la quantité de réactifs consommés est égale à la quantité de produits formés, même s’ils se sont transformés les uns dans les autres.
Ce principe fondamental des sciences naturelles a été postulé par deux scientifiques simultanément et indépendamment : le Russe Mikhail Lomonossov en 1748 et le Français Antoine Lavoisier en 1785. Il est frappant que cela se soit produit avant la découverte de l’ atome et la postulation de la théorie atomique, avec lequel il est beaucoup plus facile d’expliquer et d’illustrer le phénomène.
L’exception à la règle concerne les réactions nucléaires , dans lesquelles il est possible de convertir la masse en énergie et vice versa.
Avec l’équivalence entre masse et énergie, la loi de conservation de la matière était la clé de la compréhension de la chimie contemporaine.
Voir aussi: réaction exothermique
Contexte de la loi de conservation de la matière
La chimie de ces années comprenait les processus de réaction d’une manière très différente de celle d’aujourd’hui, allant dans certains cas jusqu’à affirmer le contraire de ce que propose cette loi.
Au 17ème siècle, Robert Boyle a expérimenté la pesée des métaux avant et après leur oxydation . Ce scientifique attribuait la variation du poids de ces métaux au gain de matière, ignorant que l’oxyde métallique qui se formait provenait de la réaction du métal avec l’oxygène de l’ air .
Découverte de la loi de conservation de la matière
Les expériences qui ont conduit Lavoisier à la découverte de ce principe ont à voir avec l’un des principaux centres d’intérêt de la chimie à l’époque : la combustion . Chauffant divers métaux, le Français s’est rendu compte qu’ils gagnaient en masse lorsqu’ils étaient calcinés s’ils étaient exposés à l’air, mais que leur masse restait la même s’ils étaient dans des récipients fermés.
Ainsi, il en a déduit que cette quantité supplémentaire de masse venait de quelque part. Il a ensuite proposé sa théorie selon laquelle la masse n’a pas été créée, mais prise de l’air . Par conséquent, dans des conditions contrôlées, la quantité de masse des réactifs peut être mesurée avant le processus chimique et la quantité de masse après, qui doit nécessairement être identique, bien que la nature des produits ne l’est plus .
Exemple de la loi de conservation de la matière
Un exemple parfait de cette loi est la combustion des hydrocarbures , dans laquelle on voit le carburant brûler et « disparaître », alors qu’en réalité il se sera transformé en gaz invisibles et en eau.
Par exemple, lors de la combustion du méthane (CH 4 ), nous aurons la réaction suivante, dont les produits seront de l’eau et des gaz invisibles, mais avec le même nombre d’atomes que les réactifs :
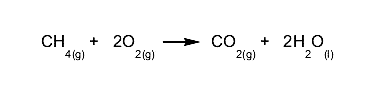
Cela peut vous aider: Principe de conservation de l’énergie