Nous expliquons ce qu’est une molécule et des exemples de cet ensemble d’atomes. De plus, les types qui existent et leur différence avec l’atome.

Qu’est-ce qu’une molécule ?
Une molécule est un ensemble d’ atomes (du même élément chimique ou de plusieurs éléments différents) qui sont organisés et reliés entre eux par des liaisons chimiques . Une molécule est également considérée comme la plus petite partie d’une substance qui conserve encore les propriétés physiques et chimiques de la substance. Les molécules sont généralement chimiquement stables et électriquement neutres.
L’ état d’agrégation d’une substance dépend principalement de la structure et des types d’atomes qui composent ses molécules, car ceux-ci déterminent les forces des interactions entre ces particules . En ce sens, les solides sont des composés qui ont très peu de séparation entre leurs molécules, les liquides ont une séparation moyenne ou intermédiaire entre leurs molécules et les gaz ont beaucoup de séparation entre leurs molécules.
L’étude des molécules et de leur nomenclature comprend non seulement le nombre d’atomes qui les composent et les propriétés qu’ils présentent, mais aussi leur compréhension à partir d’un modèle tridimensionnel de leurs liaisons et de leurs structures, c’est-à-dire de l’organisation dans l’espace de ses atomes constitutifs. Cela signifie qu’il existe des molécules qui ont la même composition atomique mais des structures spatiales différentes (et c’est pourquoi ces molécules sont nommées différemment).
Les molécules sont très courantes en chimie organique , car elles font partie des gaz atmosphériques et des océans . Cependant, il existe un grand nombre de composés chimiques dans la croûte terrestre qui ne sont pas moléculaires. Par exemple, la plupart des métaux et minéraux de la croûte terrestre ne sont pas des molécules. D’autre part, les cristaux qui composent les sels ne sont pas non plus des molécules, bien qu’ils soient constitués d’unités répétitives.
Il peut vous aider : Liaison métallique , liaison covalente , liaison ionique
exemples de molécules

Voici quelques exemples de molécules courantes :
- Oxygène : O2
- Acide chlorhydrique : HCl
- Monoxyde de carbone : CO
- Acide sulfurique : H 2 SO 4
- Éthanol : C2H5OH _ _ _
- Acide phosphorique : H 3 PO 4
- Glucose : C6H12O6 _ _ _ _
- Chloroforme : CHCl 3
- Saccharose : C12H22O11 _ _ _ _
- Acide para – aminobenzoïque : C7H7NO2 _
- Acétone : C3H6O _ _ _
- Cellulose : (C 6 H 10 O 5 ) n
- Trinitrotoluène : C7H5N3O6 _ _ _ _ _ _
- Nitrate d’argent : AgNO 3
- Urée : CO(NH 2 ) 2
- Ammoniac : NH3
types de molécules

Les molécules peuvent être classées selon la complexité de leur constitution :
- molécules discrètes. Ils présentent un nombre défini d’atomes, qu’ils soient des mêmes éléments ou d’éléments chimiques différents. Ils peuvent être classés, à leur tour, selon le nombre d’atomes différents qui composent leur structure : molécules monoatomiques (un type d’atome), molécules diatomiques (deux types d’atomes), molécules triatomiques (trois types d’atomes), molécules tétraatomiques (quatre types d’atomes), etc.
- Macromolécules ou polymères . C’est le nom donné aux grandes chaînes moléculaires. Ils sont constitués de pièces plus simples, qui s’enchaînent pour réaliser des séquences étendues et acquérir des propriétés nouvelles et spécifiques. Les plastiques , par exemple, sontun matériau composite à base de macromolécules organiques.
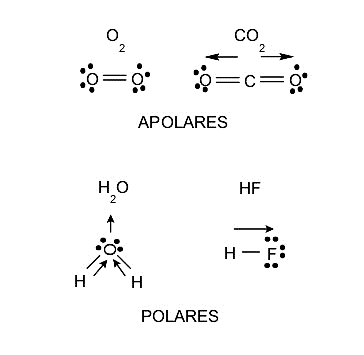
La polarité est une propriété que possèdent les molécules et est étroitement liée à la séparation des charges électriques qu’elles ont ou sont générées au sein de chaque molécule. Cette propriété influence la solubilité, car les substances polaires dissolvent les substances polaires et les substances non polaires ne dissolvent que les substances non polaires, bien qu’il existe toujours des situations intermédiaires. Les points de fusion et d’ ébullition , et même les états d’agrégation, sont également affectés par la polarité. Par conséquent, les molécules peuvent également être classées en fonction de leur polarité dans :
- molécules polaires. Ce sont ceux formés par des atomes d’électronégativité différente, c’est-à-dire que l’atome avec l’électronégativité la plus élevée attire les électrons de la liaison vers lui-même et avec une plus grande force, il y a donc une densité de charge négative autour de lui. Au lieu de cela, une densité de charge positive restera sur l’atome le moins électronégatif. Ce processus conduira éventuellement à la formation d’un dipôle, qui est un système de deux charges de signe opposé et d’amplitude égale.
- molécules non polaires. Ce sont ceux dont les atomes ont une électronégativité identique, c’est-à-dire qu’ils ne présentent pas d’inégalité vis-à-vis de l’attraction des électrons et conservent une charge neutre dans les situations ordinaires.
La symétrie d’une molécule (la position que chacun de ses atomes occupe dans sa structure) peut également influencer si une molécule est polaire ou non polaire. Il existe des molécules composées d’atomes d’électronégativité différente, mais qui sont également non polaires, car lorsque les densités de charge de différentes parties de la molécule sont ajoutées, ces charges s’annulent et la molécule se retrouve finalement avec une charge neutre, c’est-à-dire sans Charge électrique.
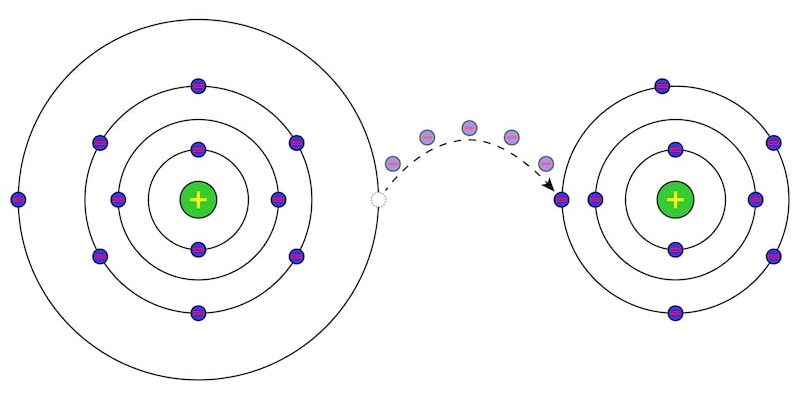
Différences entre atome et molécule

Les molécules sont constituées d’atomes reliés entre eux par des liaisons chimiques, par conséquent, les atomes sont des particules plus petites que les molécules. En effet, la plupart des molécules peuvent subir des processus de rupture ou de lyse de leurs liaisons chimiques, se transformant en molécules plus simples, ou en éléments chimiques purs, c’est-à-dire en atomes.
molécule d’eau

Une molécule d’eau ne contient que deux éléments : un atome d’oxygène et deux atomes d’hydrogène (H 2 O) liés par covalence. Celle-ci fut découverte en 1782 grâce au chimiste Henry Cavendish, puisque depuis l’Antiquité l’eau était considérée comme un élément.
L’eau a une structure non linéaire. Ses deux atomes d’hydrogène sont liés à l’atome d’oxygène et forment un angle de 104,5º entre eux. Cette répartition de ses atomes, ajoutée à la valeur élevée d’électronégativité de l’atome d’oxygène, engendre la formation d’un dipôle électrique qui détermine la polarité de l’eau . L’eau est donc une molécule polaire.
L’eau est considérée comme le solvant universel, car presque toutes les substances peuvent y être dissoutes. Les substances solubles dans l’eau sont polaires et dites hydrophiles. Les substances non polaires (non polaires), telles que l’huile ou l’essence, sont dites hydrophobes et ne se dissolvent pas dans l’eau.
La molécule d’eau, extrêmement abondante sur notre planète, fait également partie de nombreuses substances organiques et du corps des animaux et des plantes .