Nous expliquons ce qu’est le nombre d’Avogadro, quelle est la valeur de cette constante et un bref historique de son invention.
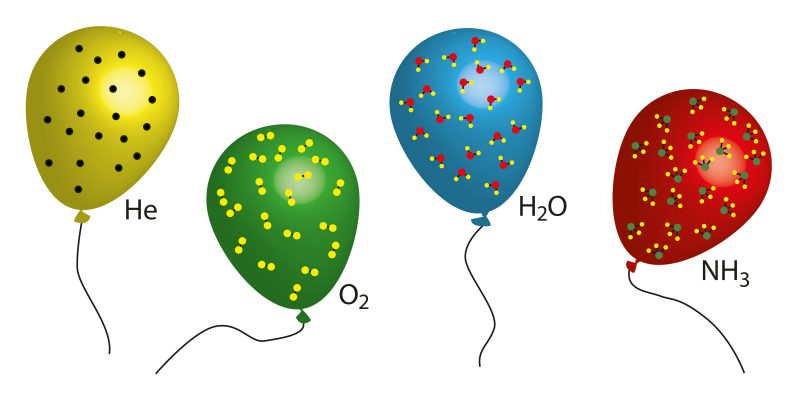
Quel est le numéro d’Avogadro ?
En chimie , le nombre de particules constitutives d’une substance (généralement des atomes ou des molécules ) que l’on peut trouver dans la quantité d’une mole de la substance est appelé nombre d’Avogadro ou constante d’Avogadro . C’est un facteur de rapport qui relie la masse molaire (grandeur physique qui définit la masse d’une substance par unité de quantité de substance et s’exprime en kg/mol) d’une substance et la masse présente dans un échantillon.
La valeur acceptée de cette constante est 6,02214087(62) x 10 23 mol -1 .
Aujourd’hui, le terme constante d’Avogadro est utilisé à la place de « nombre d’Avogadro ». La différence entre les deux termes est que la constante d’Avogadro contient des unités de mesure et que le nombre d’Avogadro est sans dimension.
Jean Baptiste Perrin a initialement défini le nombre d’Avogadro comme le nombre d’atomes dans une mole d’hydrogène (H). Cette valeur a ensuite été redéfinie comme le nombre d’atomes dans 12 grammes de l’isotope carbone-12 , puis généralisée pour relier les masses molaires aux quantités de substances.
Un exemple qui aide à comprendre cela est le suivant : dans 1 gramme d’hydrogène, il y a environ 6,022 x 10 23 atomes d’hydrogène , alors que dans 12 grammes de carbone 12, il y a exactement le même nombre d’atomes. Le gramme d’hydrogène et les 12 grammes de carbone 12 ont 6,022 x 10 23 atomes, même si la masse atomique de l’hydrogène est de 1 amu (unité de masse atomique) et celle du carbone 12 est de 12 amu.
Ceci est fondamental pour la connaissance expérimentale de la chimie . Par exemple, pour générer 1 mole d’ eau (H 2 O), 1 mole d’oxygène (6,022 x 10 23 atomes) est combinée à 2 moles d’hydrogène (2 x 6,022 x 10 23 atomes). Ceci, bien sûr, selon les mesures acceptées par le Système International (SI).
Voir aussi : Valence
Histoire du numéro d’Avogadro
La découverte de cette constante est attribuée à Amadeo Avogadro , un scientifique italien du début du XIXe siècle qui a proposé pour la première fois en 1811 qu’un volume de gaz à une pression et une température données contient le même nombre d’atomes ou de molécules, quelle que soit la température. nature même du gaz.
Le nombre d’Avogadro a cependant été postulé en 1909 sous ce nom, par le physicien français Jean Perrin, qui a remporté le prix Nobel de physique en 1926, en grande partie grâce à ses efforts pour déterminer la valeur exacte de la constante d’Avogadro à l’aide de diverses techniques et expériences expérimentales . méthodes .