Nous expliquons ce qu’est un oxydant, dans quelles réactions il intervient et quelques exemples. Carburant et énergie d’activation.

Qu’est-ce qu’un oxydant ?
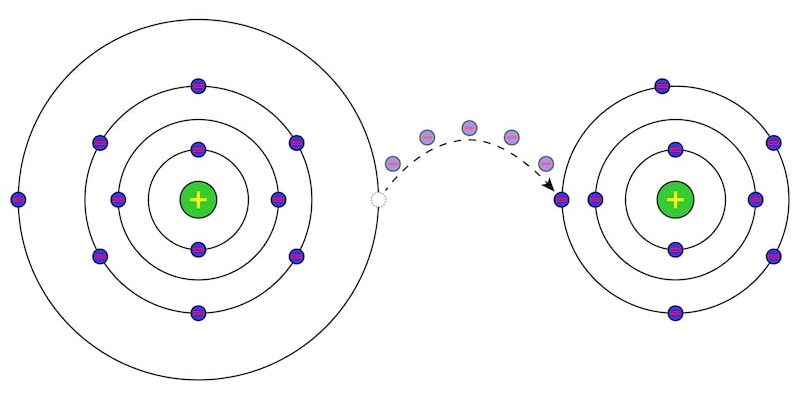
Un oxydant ou comburant est une substance ou un composé chimique qui a la propriété de se réduire , c’est-à-dire de gagner des électrons , lorsqu’il fait partie d’une réaction électrochimique ou d’oxydoréduction . Ce sont des composés chimiques qui en oxydent d’autres avec lesquels ils réagissent en éliminant des électrons.
Dans ce type de réaction, appelée redox , les deux processus se produisent simultanément : l’oxydation d’un composé (le combustible) et la réduction de l’autre (le comburant). Tous les composés impliqués ont un état d’ oxydation et de l’énergie est généralement libérée pendant la réaction, c’est-à-dire qu’il s’agit d’une réaction exothermique . L’exemple classique de ce type de réaction est la combustion .
Le comburant le plus connu de tous est l’oxygène , essentiel dans pratiquement toutes les formes de combustion, et présent dans l’ atmosphère terrestre dans des proportions pouvant atteindre 21 %. C’est pour cette raison qu’on ne peut allumer un feu sans une présence minimale d’ air , puisque l’air est un mélange d’oxygène et d’autres gaz.
Voir aussi: Phénomènes chimiques
exemples d’oxydant
Certains agents oxydants ou oxydants connus sont les suivants :
- Oxygène (O). C’est le comburant le plus répandu sur la planète Terre . En fait, nous l’utilisons dans notre corps pour oxyder les molécules de glucose dans les aliments et ainsi obtenir de l’énergie chimique pour nous maintenir en vie.
- Les décolorants. Comme l’hypochlorite (ClO – ) et d’autres hypohalites, ainsi que les chlorites (ClO 2 – ), les chlorates (ClO 3 – ) et les composés halogénés similaires.
- peroxyde d’hydrogène. Connu sous le nom de peroxyde d’hydrogène (H 2 O 2 ).
- sels de permanganate. Par exemple, le permanganate de potassium (KMnO4).
- les sulfoxydes. Par exemple, l’acide peroxosulfurique (H 2 SO 5 ).
- Réactif de Tollen. Un complexe aqueux de diamine-argent qui est utilisé dans les laboratoires, justement, comme oxydant.
- La plupart des composés contiennent du cérium (IV).
carburant et carburant
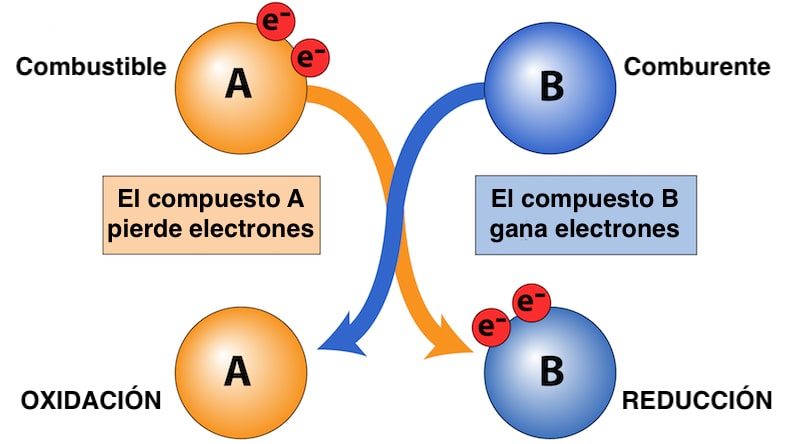
Si le comburant est le composé qui gagne des électrons lors de la réaction redox, le carburant est la substance qui cède des électrons et s’oxyde , contrairement au comburant (qui se réduit).
Ce faisant, le carburant libère une partie de son énergie chimique sous forme de chaleur , permettant ainsi, par exemple, à la combustion de se produire. Le carburant et l’oxydant sont essentiels pour que ce type de réaction chimique ait lieu .
Certains combustibles typiques sont le charbon, le bois, les hydrocarbures , l’essence, le gaz naturel , etc.
Énergie d’activation

L’énergie d’activation est une charge minimale d’énergie initiale qui déclenche la réaction . C’est le dernier élément nécessaire à la combustion, après le combustible et le comburant.
Par eux-mêmes, le carburant et le comburant ne réagissent généralement pas , mais si nous ajoutons une charge supplémentaire d’énergie, sous forme de chaleur , nous déclencherons la combustion jusqu’à ce que le carburant ait été consommé.
Un exemple clair est l’allumage d’un feu de camp. Nous avons le combustible (bois), le comburant (oxygène de l’air), mais il nous faut encore allumer une allumette ou une allumette pour démarrer la combustion.
Il en va de même avec un briquet : nous avons le combustible (gaz liquéfié), le comburant (l’oxygène de l’air) et nous n’avons besoin que de l’énergie supplémentaire de l’étincelle, produite par la rotation de la roue sur le briquet.
Continuer avec : Risque chimique