Nous expliquons ce qu’est le point d’ébullition et comment il est calculé. Exemples de point d’ébullition. Point de fusion et de congélation.

Quel est le point d’ébullition ?
Le point d’ébullition est la température à laquelle la pression de vapeur du liquide (pression exercée par la phase gazeuse sur la phase liquide dans un système fermé à une température donnée) est égale à la pression entourant le liquide. Lorsque cela se produit, le liquide se transforme en gaz.
Le point d’ébullition est une propriété qui dépend fortement de la pression ambiante . Un liquide soumis à une très haute pression aura un point d’ébullition plus élevé que si nous le soumettons à des pressions plus basses, c’est-à-dire qu’il mettra plus de temps à se vaporiser lorsqu’il est soumis à des pressions élevées. En raison de ces variations du point d’ébullition, l’IUPAC a défini le point d’ébullition standard : c’est la température à laquelle un liquide se transforme en vapeur à la pression de 1 bar.
Un point important est que le point d’ébullition d’une substance ne peut pas être augmenté indéfiniment . Lorsque nous augmentons la température d’un liquide au-delà de son point d’ébullition et que nous continuons à l’augmenter, nous arrivons à une température appelée « température critique ». La température critique est la température au-dessus de laquelle le gaz ne peut pas être transformé en liquide par augmentation de la pression, c’est-à-dire qu’il ne peut pas être liquéfié. A cette température, il n’y a pas de phase liquide ou de phase vapeur définie.
Le point d’ébullition est différent pour chaque substance. Cette propriété dépend de la masse moléculaire de la substance et du type de forces intermoléculaires qu’elle présente (liaisons hydrogène, dipôle permanent, dipôle induit), qui à son tour dépend du fait que la substance est covalente polaire ou covalente non polaire (non polaire). .
Lorsque la température d’une substance est inférieure à son point d’ébullition, seule une partie de ses molécules situées à sa surface aura suffisamment d’ énergie pour briser la tension superficielle du liquide et s’échapper vers la phase vapeur. D’autre part, lorsque de la chaleur est fournie au système, il y a une augmentation de l’ entropie du système (la tendance des particules du système à se désorganiser).
Voir aussi: Propriétés de la matière
Comment est calculé le point d’ébullition ?
En utilisant l’équation de Clausius-Clapeyron, les transitions de phase d’un système composé d’un seul composant peuvent être caractérisées. Cette équation peut être utilisée pour calculer le point d’ébullition des substances et s’applique comme suit :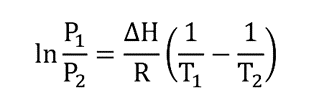
Où:
P 1 est la pression égale à 1 bar, soit en atmosphères (0,986923 atm)
T 1 est la température d’ébullition (point d’ébullition) du composant, mesurée à une pression de 1 bar (P 1 ) et exprimée en degrés Kelvin (K).
P 2 est la pression de vapeur du composant exprimée en bar ou atm.
T 2 est la température du composant (exprimée en degrés Kelvin) à laquelle est mesurée la pression de vapeur P 2 .
H est l’enthalpie moyenne de la variation de vaporisation dans la plage de température calculée. Elle est exprimée en J/mol ou unités d’équivalent énergétique.
R est la constante des gaz équivalente à 8 314 J/Kmol
ln est le logarithme naturel
La température d’ébullition (point d’ébullition) T 1 est effacée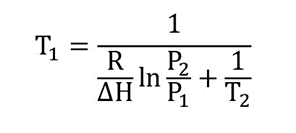
Exemples de point d’ébullition
Certains points d’ébullition connus et enregistrés dans des conditions de pression normales (1 atm) sont les suivants :
- Eau : 100ºC
- Hélium : -268,9 ºC
- Hydrogène : -252,8 ºC
- Calcium : 1 484 °C
- Béryllium : 2471 ºC
- Silicium : 3 265 °C
- Carbone sous forme de graphite : 4827 ºC
- Bore : 3927ºC
- Molybdène : 4639ºC
- Osmium : 5012 ºC
- Wolfram : 5930 ºC
Point de fusion

La température à laquelle un solide se transforme en liquide s’appelle le point de fusion et pendant la transition de phase solide-liquide, la température est maintenue constante. Dans ce cas, de la chaleur est fournie au système jusqu’à ce que sa température augmente suffisamment pour que le mouvement de ses particules dans la structure solide soit plus important, les obligeant à se séparer et à s’écouler dans la phase liquide.
Le point de fusion dépend également de la pression et est généralement égal au point de congélation de la matière (où un liquide devient un solide en refroidissant suffisamment) pour la plupart des substances .
Continuer sur : Point de fusion
Point de congélation
Le point de congélation est l’opposé du point de fusion, c’est-à-dire la température à laquelle un liquide se contracte , ses particules perdent leur mouvement et acquièrent une structure plus rigide , résistante à la déformation et à mémoire de forme (unique des substances) . ). C’est-à-dire que c’est la température à laquelle le liquide se transforme en solide. La fusion nécessite de fournir de l’énergie thermique au système, tandis que la congélation nécessite de retirer de l’énergie thermique (refroidissement).
D’autre part, le point de congélation dépend également de la pression . Un exemple est ce qui se passe lorsque l’eau est refroidie à une température de 0 ºC à 1 atm, lorsqu’elle gèle et se transforme en glace. S’il est refroidi à une pression très différente de 1 atm, le résultat pourrait être très différent, par exemple, si la pression est beaucoup plus élevée, il pourrait mettre du temps à geler, car son point de congélation diminue.
Point de fusion et point d’ébullition de l’eau
L’eau est souvent utilisée comme étalon pour mesurer les points de fusion et d’ébullition de substances. De manière générale, à pression normale, son point d’ébullition est de 100 ºC et son point de fusion est de 0 ºC (dans le cas de la glace). Cela peut varier considérablement dans les cas où l’ eau contient d’autres substances dissoutes, liquides ou solides, comme c’est le cas de l’eau de mer, riche en sels, qui modifie ses propriétés physiques et chimiques.
L’impact de la pression est également très perceptible. On sait qu’à 1 atm, le point d’ébullition de l’eau est de 100 ºC , mais en le portant à 0,06 atm, nous serions surpris de constater que l’ébullition se produit à 0 ºC (au lieu de geler).