Nous expliquons ce qu’est la solubilité en chimie et quels facteurs l’affectent. Aussi, quel est le produit de solubilité et divers exemples.

Qu’est-ce que la solubilité ?
En chimie , la solubilité est la capacité d’un corps ou d’une substance donnée (appelée soluté ) à se dissoudre dans un milieu donné (appelé solvant ) ; c’est-à-dire qu’il s’agit de la quantité maximale de soluté qu’un solvant peut recevoir dans certaines conditions environnementales.
Le soluté est la substance qui se dissout dans un certain solvant. Il peut s’agir d’un solide , d’un liquide ou d’un gaz . Le soluté se trouve généralement en moins grande quantité que le solvant dans une solution .
Le solvant ou solvant est la substance dans laquelle un certain soluté se dissout. Le solvant se trouve généralement en plus grande quantité que le soluté dans une solution.
La solubilité peut être exprimée par des unités de concentration , telles que la molarité ou la molalité, par exemple.
La concentration molaire (appelée molarité) est définie comme le nombre de moles de soluté par litre de solution (ou unité équivalente) et est calculée comme suit :
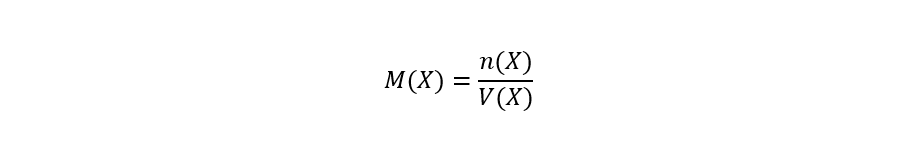
Où:
- M(X). Molarité de la substance X exprimée en mol/L.
- n(X). Quantité de substance de la substance X exprimée en moles (mol).
- V(X). Volume de solution exprimé en litres (L) ou unités équivalentes.
La concentration molaire (appelée molalité) est définie comme le nombre de moles de soluté dans un kilogramme de solvant et est calculée comme suit :
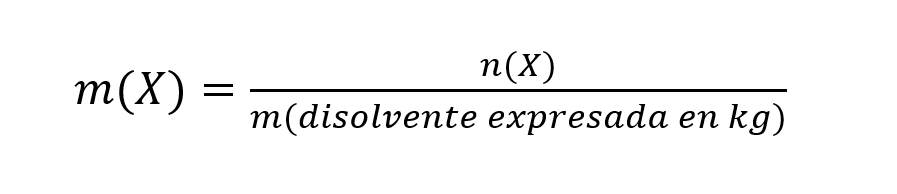
Où:
- m(X). C’est la molalité de la substance X exprimée en mol/(kg de solvant).
- n(X). C’est la quantité de substance de la substance X exprimée en moles (mol).
- m(solvant exprimé en kg). C’est la masse de solvant exprimée en kg.
Cependant, la solubilité n’est pas une caractéristique universelle de toutes les substances. Certains se dissolvent facilement, d’autres plus difficilement, et certains ne se dissolvent tout simplement pas.
Tout dépend aussi des substances que nous mélangeons. L’eau , communément appelée solvant universel, ne peut pas dissoudre complètement l’huile, par exemple.
Mais même lorsqu’un solvant parvient à dissoudre un soluté, il le fait dans une certaine mesure, grâce à quoi les solutions peuvent être classées en :
- Saturé. Lorsque plus aucun soluté ne peut être dissous, c’est-à-dire lorsque la solution contient la quantité maximale de soluté admise par le solvant.
- Non saturé. Lorsque plus de soluté peut continuer à se dissoudre dans la solution.
- sursaturé. Lorsque la solution contient plus de soluté qu’elle ne peut en dissoudre. Une solution sursaturée peut être obtenue en modifiant certaines conditions, telles que la température, pour provoquer la dissolution de plus de soluté que le maximum admis par la solution.
Voir aussi: Soluté et solvant
Facteurs affectant la solubilité

En principe, la solubilité d’une substance dépend de l’autre substance avec laquelle nous la mélangeons. D’une manière générale, les substances sont classées en:
- Soluble dans l’eau. Ce sont ceux qui peuvent se dissoudre plus facilement (ou complètement) dans l’eau.
- Liposoluble. Ce sont ceux qui peuvent se dissoudre plus facilement dans les huiles.
D’autre part, la solubilité des substances dépend des facteurs suivants :
température . La plupart des solides augmentent leur solubilité dans l’eau avec l’augmentation de la température, bien qu’il y ait quelques exceptions. De plus, les composés organiques augmentent généralement leur solubilité avec l’augmentation de la température. Cette augmentation de la solubilité avec l’augmentation de la température est due au fait que les interactions entre les particules du soluté et le solvant augmentent , de sorte que les forces intermoléculaires entre elles peuvent être rompues. En revanche, les solutés gazeux ont un comportement différent, car à mesure que la température augmente, leur solubilité dans les solvants organiques augmente, mais diminue dans l’eau car le gaz a tendance à s’échapper du liquide avec l’augmentation de la température.
Par exemple, un verre d’eau dissout une certaine quantité de sucre, jusqu’à ce que l’excès commence à précipiter au fond. Si nous chauffons ledit verre d’eau, nous remarquerons comment l’excès commence à disparaître, augmentant la solubilité du soluté dans le solvant.
pression . La pression influence principalement la solubilité des solutés gazeux. En augmentant la pression d’un soluté gazeux, sa solubilité dans un certain solvant augmente.
Nature du soluté et du solvant. Les substances de même polarité sont solubles les unes dans les autres, d’où l’expression: « comme se dissout comme » découle. Cependant, lorsqu’un soluté et un solvant ont des polarités différentes, ils sont complètement insolubles l’un dans l’autre, bien qu’il existe toujours une gamme de polarités intermédiaires dans laquelle un soluté et un solvant peuvent être partiellement solubles.
La polarité est une propriété des composés chimiques qui ont tendance à séparer les charges électriques dans leur structure.
Les molécules polaires sont constituées d’atomes dont l’électronégativité est très différente, tandis que les molécules non polaires sont constituées d’ atomes ayant la même électronégativité.
Mais la polarité d’une molécule est aussi déterminée par la symétrie de sa structure, il peut donc y avoir des molécules composées d’atomes dont l’électronégativité est différente, mais elles sont disposées de telle manière dans la structure moléculaire que leurs dipôles s’annulent et finalement la molécule c’est apolaire
Agitation. L’agitation ou l’agitation des solutions augmente la solubilité du soluté, car elle contribue à une plus grande interaction entre le soluté et le solvant.
Voir aussi: forces de Van der Waals
produit de solubilité
Lorsque l’on parle de produit de solubilité ou de produit ionique (en abrégé Ksol ou Ks ), on se réfère au produit des concentrations molaires des ions qui forment un composé , élevés à leurs indices stoechiométriques respectifs de l’équation d’équilibre. Ainsi, plus le Ksol est élevé , plus le composé est soluble. Ceci est exprimé par la formule suivante, en considérant l’équation d’équilibre :
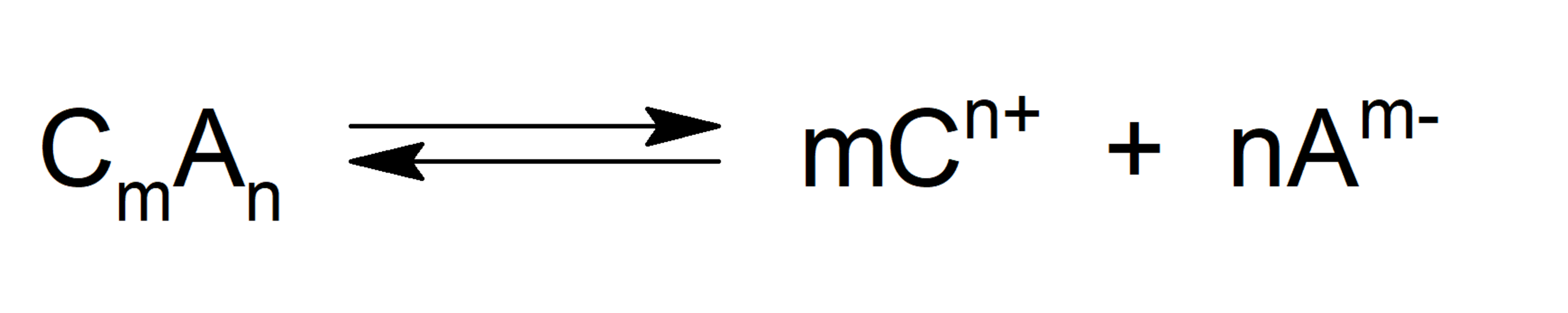
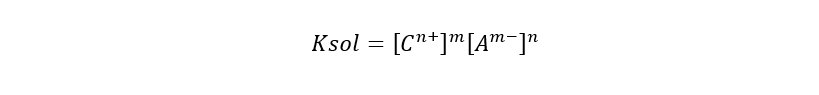
Où:
- Ksol. C’est le produit de solubilité.
- [C n+ ] m . C’est la concentration molaire du cation élevée au coefficient stoechiométrique m .
- [A m- ] n . C’est la concentration molaire de l’anion élevée au coefficient stoechiométrique n .
Exemples de solubilité

- Sel dissous dans l’eau. Le sel commun (chlorure de sodium, NaCl) se dissout facilement dans l’eau, à raison de 360 grammes par litre, tant que l’eau est à 20°C. Si nous augmentons la température du solvant, la quantité de sel que nous pouvons dissoudre augmentera.
- Sodas. Les boissons gazeuses en canette ou en bouteille que nous consommons quotidiennement contiennent une quantité de dioxyde de carbone gazeux (CO 2 ) dissous, et c’est pourquoi elles ont leur bouillonnement caractéristique. Pour y parvenir, les industriels sursaturent le mélange dans des conditions de très haute pression. Par conséquent, lorsque nous les découvrons, la pression s’équilibre et une fuite de gaz commence.
- solutions iodées. Nous utilisons souvent des solutions d’iode pour cicatriser les plaies superficielles, qui ne peuvent pas être faites avec de l’eau, car l’iode n’est pas soluble dans l’eau. C’est pourquoi ils utilisent de l’alcool , dont le taux de solubilité s’améliore et permet de réaliser le mélange.
- Café au lait. Pour préparer un café con leche, nous ajoutons le lait à l’infusion et observons son changement de couleur au fur et à mesure qu’il se mélange. Cela se fait toujours avec du café chaud, car le taux de solubilité des deux substances augmente avec la température. Cependant, si nous attendons que les substances refroidissent, nous remarquerons la formation de crème à la surface, car la solution s’est saturée plus rapidement.
Continuer avec : Solution chimique