Nous expliquons ce qu’est le tableau périodique et quelle est son histoire. Aussi, comment il est organisé et quels sont les différents groupes qu’il contient.
Qu’est-ce que le tableau périodique ?
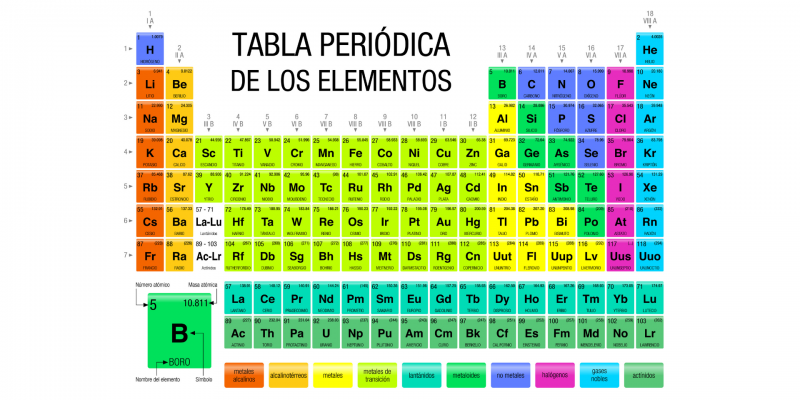
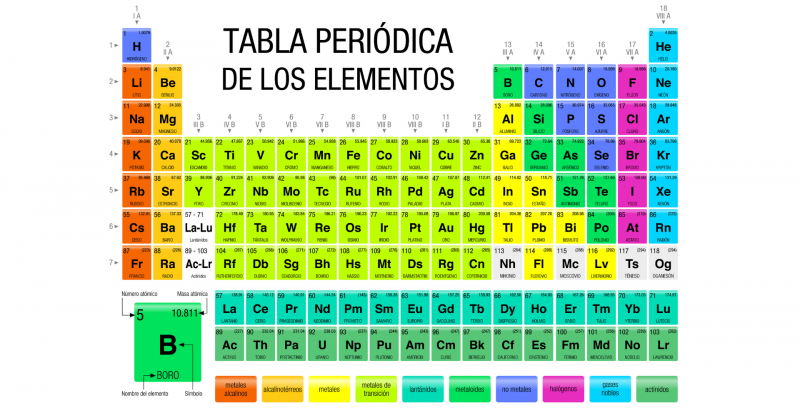
Le tableau périodique des éléments est un enregistrement de tous les éléments chimiques connus de l’humanité . Les éléments sont classés sous forme de tableau selon leur numéro atomique (nombre de protons ), leur configuration électronique et leurs propriétés chimiques.
Dans ce tableau, les éléments sont organisés en lignes et en colonnes qui présentent une certaine périodicité : les éléments appartenant à une même colonne ont des propriétés similaires. En principe, toute la matière connue dans l’ univers est composée de diverses combinaisons des 118 éléments, enregistrés dans le tableau périodique.
Des symboles, appelés symboles chimiques, ont été établis pour représenter chaque élément du tableau périodique, qui sont également identifiés selon leurs états d’agrégation ( solide , liquide ou gazeux ) à une température de 0 °C et à une pression de 1 atm.
Le tableau périodique est un outil fondamental pour la chimie , la biologie et d’autres sciences naturelles , mis à jour au fil des ans à mesure que nous en apprenons davantage sur les propriétés de la matière et les relations entre les éléments.
Voir aussi: Liaison chimique
histoire du tableau périodique
La première version du tableau périodique a été publiée en 1869 par le professeur de chimie russe Dmitri Mendeleyev, et elle contenait 63 des 118 éléments connus dans la nature aujourd’hui et était organisée en fonction de leurs propriétés chimiques. D’autre part, le professeur de chimie allemand Julius Lothar Meyer a publié une version élargie mais basée sur les propriétés physiques des atomes . Les deux érudits ont organisé les éléments en rangées, ayant la prévoyance de laisser des espaces vides où ils avaient l’intuition qu’il y aurait encore des éléments à découvrir.
En 1871, Mendeleev a publié une autre version du tableau périodique qui regroupait les éléments selon leurs propriétés communes dans les colonnes numérotées de I à VIII selon l’ état d’ oxydation de l’élément.
Enfin, en 1923, le chimiste américain Horace Groves Deming publie un tableau périodique à 18 colonnes identifiées qui constitue la version utilisée aujourd’hui.
Comment est organisé le tableau périodique ?
Le tableau périodique actuel est structuré en sept lignes (horizontales) appelées périodes et en 18 colonnes (verticales) appelées groupes ou familles . Les éléments chimiques sont disposés dans l’ordre croissant de leurs numéros atomiques, c’est-à-dire que le numéro atomique augmente de gauche à droite dans la période et de haut en bas dans le groupe.
Les dix-huit groupes connus sont :
- Groupe 1 (AI). Métaux alcalins : lithium (Li), sodium (Na), potassium (K), rubidium (Rb), césium (Cs), francium (Fr). Dans ce groupe se trouve également l’hydrogène (H), qui est un gaz.
- Groupe 2 (IIA). Métaux alcalino-terreux : béryllium (Be), magnésium (Mg), calcium (Ca), strontium (Sr), baryum (Ba), radium (Ra).
- Groupe 3 (IIIB). La famille du scandium (Sc) qui comprend l’yttrium (Y) et les terres rares : lanthane (La), cérium (Ce), praséodyme (Pr), néodyme (Nd), prométhium (Pm), samarium (Sm), europium ( Eu), gadolinium (Gd), terbium (Tb), dysprosium (Dy), holmium (Ho), erbium (Er), thulium (Tm), ytterbium (Yt), lutétium (Lu). Sont également inclus les actinides : actinium (Ac), thorium (Th), protactinium (Pa), uranium (U), neptunium (Np), plutonium (Pu), américium (Am), curium (Cm), berkelium (Bk) , californium (Cf), einsteinium (Es), fermium (Fm), mendélévium (Md), nobélium (No) et lawrencium (Lr).
- Groupe 4 (BVI). La famille du titane (Ti), qui comprend le zirconium (Zr), l’hafnium (Hf) et le rutherfordium (Rf), ce dernier synthétique et radioactif.
- Groupe 5 (VB). La famille du vanadium (V) : le niobium (Nb), le tantale (Ta) et le dubnium (Db), ce dernier étant synthétique.
- Groupe 6 (VIB). La famille du chrome (Cr) : molybdène (Mb), tungstène (W) et seaborgium (Sg), ce dernier étant synthétique.
- Groupe 7 (VIB). La famille du manganèse (Mn) : le rhénium (Re), le technétium (Tc) et le bohrium (Bh), ces deux derniers étant synthétiques.
- Groupe 8 (VIIIB). La famille du fer (Fe) : ruthénium (Ru), osmium (Os) et hassium (Hs), ce dernier synthétique.
- Groupe 9 (VIIIB). La famille du cobalt (Co) : le rhodium (Rh), l’iridium (Ir) et le meitneiro synthétique (Mt).
- Groupe 10 (VIIIB). La famille du nickel (Ni) : le palladium (Pd), le platine (Pt) et le darmstadtium synthétique (Ds).
- Groupe 11 (IB). La famille du cuivre (Cu) : l’argent (Ag), l’or (Au) et le roentgenium synthétique (Rg).
- Groupe 12 (IIB). La famille du zinc (Zn) : le cadmium (Cd), le mercure (Hg) et le copernicium synthétique (Cn).
- Groupe 13 (IIIA). Les éléments terrestres : le bore (Br), l’aluminium (Al), le gallium (Ga), l’indium (In), le thallium (Tl) et le nihonium synthétique (Nh).
- Groupe 14 (TVA). Carbonoïdes : carbone (C), silicium (Si), germanium (Ge), étain (Sn), plomb (Pb) et le phlévorium synthétique (Fl).
- Groupe 15 (VA). Les azotés : l’azote (N), le phosphore (P), l’arsenic (As), l’antimoine (Sb), le bismuth (Bi) et le moscovium synthétique (Mc).
- Groupe 16 (VIA). Les chalcogènes ou amphigènes : oxygène (O), soufre (S), sélénium (Se), tellure (Te), polonium (Po) et le livermorium synthétique (Lv).
- Groupe 17 (VIIA). Les halogènes : le fluor (F), le chlore (Cl), le brome (Br), l’iode (I), l’astatine (At) et le teneso synthétique (Ts).
- Groupe 18 (VIIIA). Les gaz nobles : l’hélium (He), le néon (Ne), l’argon (Ar), le krypton (Kr), le xénon (Xe), le radon (Rn), et l’oganesson synthétique (Og).