Nous expliquons ce qu’est un électron, quelles sont ses caractéristiques et comment cette particule subatomique a été découverte.

Qu’est-ce qu’un électron ?
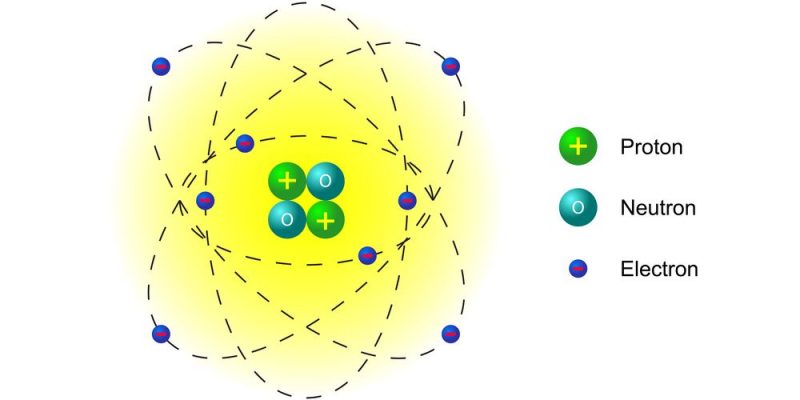
Un électron est un type de particule subatomique qui a une charge électrique négative et tourne activement autour du noyau atomique (composé de protons et de neutrons ), qui a une charge électrique positive.
La taille d’un électron est 1836 fois plus petite que celle des protons (ils contribuent à 0,06% de la masse totale d’un atome ) et, comme il n’a pas de sous-structures ou de divisions, il est considéré comme une particule élémentaire de matière .
Les électrons jouent un rôle essentiel dans certaines forces et phénomènes physiques de la nature , comme l’ électricité , le magnétisme ou la conductivité thermique , et déterminent dans une large mesure les liaisons atomiques, qu’elles soient ioniques (perte ou gain d’électrons) ou covalentes (d’utilisation conjointe d’électrons). . Les électrons génèrent des champs électriques qui affectent les particules chargées qui les entourent.
L’origine des électrons, selon la théorie la plus admise concernant l’origine de l’ univers , indique qu’ils se sont formés durant les premières millisecondes du Big Bang , dont les températures ont dépassé 1010 K, suffisamment pour former des paires de positrons (e+) – électrons ( e-) qui s’annihilaient parce qu’ils avaient la charge électrique opposée.
Pour des raisons inconnues, le nombre d’électrons était bien supérieur à celui des protons, ils ont donc survécu et ont commencé à être attirés par les premiers protons lorsque l’univers s’est suffisamment refroidi, formant ainsi les atomes les plus élémentaires de la nature.
Le nombre d’électrons dans les atomes de la matière détermine si celle-ci a une charge neutre (équilibre entre protons et électrons), positive (manque d’électrons) ou négative (excès d’électrons).
Parallèlement, il existe des électrons « libres » qui peuvent se déplacer d’un atome à l’autre de la matière, générant des flux électriques ou des champs magnétiques , selon la température à laquelle ils se trouvent. Il existe des matériaux appelés conducteurs , dans lesquels les électrons peuvent se déplacer librement d’un atome à l’autre et générer ainsi des flux d’atomes en mouvement, appelés courants électriques .
Voir aussi: modèle atomique de Rutherford
Caractéristiques d’un électron
Les électrons appartiennent à une classe de particules élémentaires appelées leptons. Il existe également deux autres groupes de particules élémentaires appelées quarks et bosons. Pour chaque type de particule, il existe trois familles ou générations.
Les électrons sont les leptons chargés électriquement les moins massifs de l’ensemble et appartiennent à la première génération de particules fondamentales (les deuxième et troisième générations contiennent des particules de muon et de tau).
La masse d’un électron est toujours de 9,019 x 10-31 kg et sa charge électrique respective est de -1,602 x 10-19 coulombs , ce qui représente une charge identique à celle du proton, mais de signe opposé. Cette mesure est connue sous le nom de charge élémentaire de la nature.
Qui a découvert l’électron ?
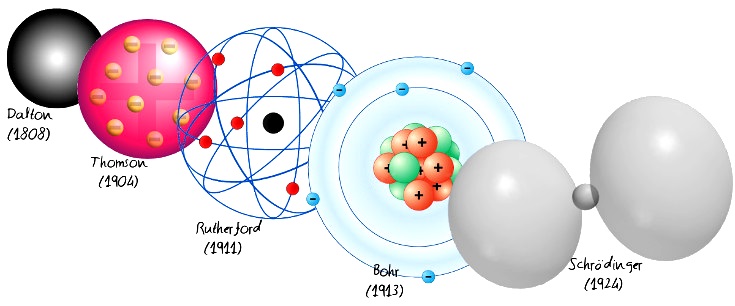
L’électron a été découvert à la fin du XIXe siècle, grâce à des investigations successives dans le domaine de la conductivité électrique des gaz . À l’aide de rayons cathodiques, des phénomènes ont été observés qui ont conduit à la conclusion que ces rayons étaient des particules chargées négativement, initialement appelées corpuscules et qu’elles avaient un millième de la masse de l’ ion hydrogène , le moins massif de tous les atomes. Ce qui est curieux, c’est qu’en faisant varier la nature du gaz utilisé, ces particules ont conservé toutes leurs caractéristiques.
A la fin du 19e siècle, l’Irlandais George Francis Fitzgerald les baptise « électrons » , un nom qui dès le début jouit d’une acceptation générale. L’appartenance de ces particules à la structure de l’atome a été postulée vers 1900, grâce aux expériences de Rutherford, Moseley, Franck et Hertz, et au modèle atomique proposé plus tard par Niels Bohr.