Nous vous expliquons ce qu’est le lithium et d’où vient cet élément chimique. Découverte, usages et présence dans le corps humain.

Qu’est-ce que le lithium ?
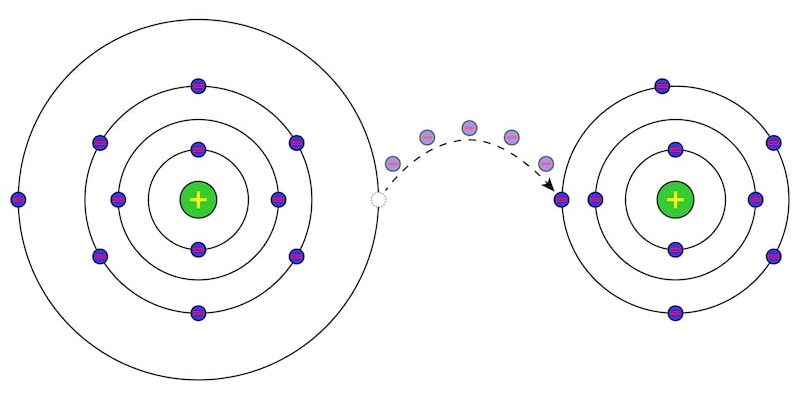
Le lithium (Li) est un élément chimique alcalin, métallique, diamagnétique mais hautement réactif qui s’oxyde rapidement dans l’air ou l’eau . Dans sa forme pure, il s’agit d’un métal doux, blanc argenté et extrêmement léger qui ne se trouve pas à l’état libre dans la nature .
C’est un élément similaire au sodium, moyennement abondant sur notre planète, notamment dans les routes volcaniques ou les salines (85% de ses réserves se trouvent sur le territoire bolivien, chilien et argentin). Avec l’hydrogène et l’hélium, le lithium est l’un des tout premiers éléments de l’ univers , dont la création répondrait au même big bang .
Son nom vient du mot grec lithios, qui signifie « pierre », car il a été découvert dans l’Antiquité dans le cadre de gros rochers. Sa compréhension moderne remonte à 1817, lorsque Johann Arfvedson l’a découvert dans une mine de pétalite en Suède. Sa production par électrolyse fut cependant beaucoup plus tardive et sa commercialisation débuta en 1923 par une société allemande .
Comme les autres métaux alcalins, le lithium est hautement inflammable et potentiellement explosif lorsqu’il est exposé à l’air ou, plus encore, à l’eau. Il est également corrosif et en grande quantité peut être toxique, en inhibant l’absorption de l’iode vital pour les hormones thyroïdiennes.
Il peut vous aider : Conductivité électrique
Utilisations du lithium

Le lithium a les applications suivantes :
- Psychopharmaceutiques. Les sels de lithium (tels que le carbonate de lithium) sont utilisés en médecine psychiatrique comme stabilisateur de l’humeur, car ils inhibent les épisodes de manie et de dépression associés à la maladie bipolaire et à d’autres troubles de l’humeur.
- Sécante. Les composés tels que le nitrate de lithium, le chlorure de lithium ou le bromure de lithium sont fortement hygroscopiques, c’est-à-dire qu’ils absorbent fortement l’ humidité atmosphérique , et permettent ainsi de sécher l’air dans des compartiments fermés.
- Laveurs. Pour éliminer le dioxyde de carbone de l’air , l’hydroxyde de lithium est utilisé comme épurateur dans les sous-marins et les engins spatiaux.
- Alliages . Il est utilisé dans les alliages avec l’aluminium, le cadmium, le cuivre et le manganèse pour fabriquer des céramiques, des lentilles et dans la construction aéronautique.
- lubrifiants Certains sels de lithium et d’acide stéarique, comme le stéarate de lithium, sont utilisés dans la fabrication de lubrifiants haute température .
- Fabrication de batteries . Son potentiel électrochimique le rend idéal pour l’anode (pôle positif) des batteries électriques.
Lithium dans le tableau périodique

Le lithium est représenté par le symbole chimique Li et se trouve dans le tableau périodique du groupe 1, avec le reste des métaux alcalins tels que le sodium (Na), le potassium (K), le rubidium (Rb), le césium (Cs) et le francium. (Fr). Son numéro atomique est 3.
lithium dans le corps humain
Le lithium peut causer des dommages au corps humain , par exemple en entrant en contact avec la peau. Étant un déshydratant puissant, il en extrait rapidement l’ humidité , provoquant des brûlures.
L’apport de composés de lithium en quantité contrôlée peut être bénéfique face à certaines affections psychiatriques puisqu’il agit sur certains neurotransmetteurs, stabilisant l’humeur.
Cependant, il augmente la perméabilité cellulaire en remplaçant le sodium dans les membranes cellulaires , empêchant les performances de la pompe à substrat sodium-potassium ATPase, qui est toxique à grande échelle.