Nous expliquons ce que sont les métaux, comment ils sont classés et quelles sont leurs propriétés physiques. Exemples de métaux et quels sont les non-métaux.

Que sont les métaux ?
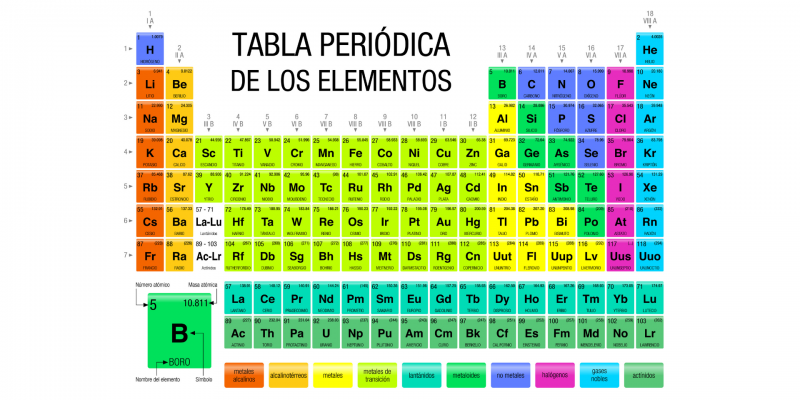
Dans le domaine de la chimie , les métaux ou métaux sont les éléments du tableau périodique qui se caractérisent par être de bons conducteurs d’ électricité et de chaleur . Ces éléments ont des densités élevées et sont généralement solides à température ambiante (sauf pour le mercure). Beaucoup, en plus, peuvent réfléchir la lumière , ce qui leur donne leur éclat caractéristique.
Les métaux sont les éléments les plus nombreux du tableau périodique et certains sont parmi les plus abondants de la croûte terrestre . Une partie d’entre eux se trouve généralement dans un état de pureté plus ou moins grande dans la nature , bien que la plupart fassent partie des minéraux du sous-sol terrestre et doivent être séparés par l’homme pour les utiliser.
Les métaux ont des liaisons caractéristiques appelées « liaisons métalliques » . Dans ce type de liaison, les atomes métalliques sont liés entre eux de telle sorte que leurs noyaux atomiques se rejoignent avec les électrons de valence ( électrons situés dans la dernière couche électronique, c’est-à-dire les électrons les plus externes), qui forment une sorte de « nuage » . » autour d’elle. Ainsi, dans la liaison métallique, les atomes métalliques sont situés très proches les uns des autres, et tous sont « immergés » dans leurs électrons de valence, formant la structure métallique.
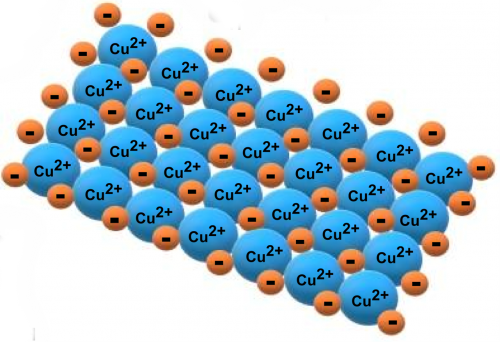
D’autre part, les métaux peuvent former des liaisons ioniques avec des non-métaux (par exemple le chlore et le fluor), entraînant la formation de sels. Ce type de liaison est formé par l’attraction électrostatique entre des ions de signes différents, où les métaux forment des ions positifs (cations) et les non-métaux forment des ions négatifs (anions). Lorsque ces sels se dissolvent dans l’eau, ils se dissocient en leurs ions .
Même les alliages d’un métal avec un autre (ou avec un non-métal) restent des matériaux métalliques, comme c’est le cas de l’acier et du bronze, même s’il s’agit de mélanges homogènes .
Les métaux ont servi l’humanité depuis des temps immémoriaux grâce à leur caractère idéal pour former des outils, des statues ou des structures de toutes sortes, en raison de leurs propriétés physiques particulières :
- Malléabilité. Lorsqu’ils sont soumis à la compression, certains métaux peuvent former de fines feuilles de matériau homogène.
- Ductilité. Soumis à des efforts de traction, certains métaux peuvent former des fils ou des fils de matière homogène.
- Ténacité. Capacité à résister à la rupture, lorsqu’il est soumis à des forces soudaines (coups, chutes, etc.).
- Force mécanique. Capacité à résister à la traction, à la compression, à la torsion et à d’autres forces sans céder sa structure physique ni se déformer.
De plus, leur brillance les rend idéales pour forger des bijoux et des éléments décoratifs, et leur bonne conductivité de l’électricité les rend indispensables à la transmission du courant électrique dans les systèmes d’alimentation électrique modernes .
Voir aussi: conductivité électrique
types de métaux

Les éléments métalliques peuvent être de différents types, selon lesquels ils sont regroupés dans le tableau périodique. Chaque groupe a des propriétés partagées :
- Métaux alcalins. Ils sont brillants, doux et très réactifs dans des conditions normales de pression et de température (1 atm et 25º C), ils ne sont donc jamais purs dans la nature . Ils ont de faibles densités et sont de bons conducteurs de chaleur et d’électricité. Ils ont également des points de fusion et d’ébullition bas. Dans le tableau périodique, ils occupent le groupe I (1). Dans ce groupe se trouve également l’hydrogène (qui n’est pas un métal).
- métaux alcalino-terreux. Ils sont situés dans le groupe II (2) du tableau périodique. Son nom vient des propriétés alcalines de ses oxydes (anciennement appelés « terres »). Ils ont tendance à être plus durs et moins réactifs que les alcalins. Ils sont brillants et bons conducteurs de chaleur et d’électricité. Ils ont une densité et une couleur faibles .
- métaux de transition. La plupart des métaux entrent dans cette catégorie. Ils occupent la région centrale du tableau périodique et presque tous sont durs, avec des points de fusion et d’ ébullition élevés et une bonne conduction de la chaleur et de l’électricité.
- Lanthanides. Aussi appelées lanthanoïdes, ce sont les « terres rares » du tableau périodique, qui avec les actinides forment les « éléments de transition interne ». Ce sont des éléments très similaires les uns aux autres, et malgré leur nom, ils sont très abondants à la surface de la terre. Ils ont des comportements magnétiques (lorsqu’ils interagissent avec un champ magnétique, par exemple, le champ magnétique généré par un aimant ) et spectraux (lorsqu’un rayonnement les frappe) très caractéristiques.
- Actinides. Avec les terres rares, ils forment les « éléments de transition internes » et sont très similaires les uns aux autres. Ils ont des numéros atomiques élevés et beaucoup d’entre eux sont radioactifs dans tous leurs isotopes, ce qui les rend extrêmement rares dans la nature.
- Transactinides. Aussi appelés « éléments superlourds », ce sont ceux qui dépassent en nombre atomique le plus lourd des actinides, le lawrencium (103). Tous les isotopes de ces éléments ont une demi-vie très courte, sont tous radioactifs et ont été synthétisés en laboratoire, ils portent donc les noms des physiciens responsables de leur création.
exemples de métaux

- Alcalin. Lithium (Li), sodium (Na), potassium (K), rubidium (Rb), césium (Cs), francium (Fr).
- Terre alcaline. Béryllium (Be), magnésium (Mg), calcium (Ca), strontium (Sr), baryum (Ba) et radium (Ra).
- métaux de transition. Scandium (Sc), Titane (Ti), Vanadium (V), Chrome (Cr), Manganèse (Mn), Fer (Fe), Cobalt (Co), Nickel (Ni), Cuivre (Cu), Zinc (Zn), yttrium (Y), zirconium (Zr), niobium (Nb), molybdène (Mo), technétium (Tc), ruthénium (Ru), rhodium (Rh), palladium (Pd), argent (Ag), cadmium (Cd), Lutétium (Lu), Hafnium (Hf), Tantale (Ta), Tungstène (W), Rhénium (Re), Osmium (Os), Iridium (Ir), Platine (Pd), Or (Au), Mercure (Hg), Lawrencium (Lr), Rutherfordium (Rf), Dubnium (Db), Seaborgium (Sg), Bohrium (Bh), Hassium (Hs), Meitnerium (Mt), Darmstadium (Ds), Roentgenium (Rg), Copernicium (Cn).
- terres rares. Lanthane (La), cérium (Ce), praséodyme (Pr), néodyme (Nd), prométhium (Pm), samarium (Sm), europium (Eu), gadolinium (Gd), terbium (Tb), dysprosium (Dy), holmium (Ho), erbium (Er), thulium (Tm), ytterbium (Yb), lutétium (Lu).
- Actinides. Actinium (Ac), Thorium (Th), Protactinium (Pa), Uranium (U), Neptunium (Np), Plutonium (Pu), Américium (Am), Curium (Cm), Berkelium (Bk), Californium (Cf), Einsteinium (Es), Fermium (Fm), Mendelevium (Md), Nobelium (No), Lawrencium (Lr).
- Transactinides. Rutherfordium (Rf), Dubnium (Db), Seaborgium (Sg), Bohrium (Bh), Hassium (Hs), Meitnerium (Mt), Darmstadium (Ds), Roentgenium (Rg), Copernicium (Cn), Nihonium (Nh), flerovio (Fl), moscovio (Mc), livermorio (Lv), teneso (Ts).
Que sont les non-métaux ?

Les non-métaux sont des éléments aux propriétés très différentes de celles des métaux, bien qu’il existe également des composés appelés métalloïdes , qui ont des propriétés et des caractéristiques intermédiaires entre les métaux et les non-métaux. Les non- métaux forment des liaisons covalentes lorsqu’ils forment des molécules les uns avec les autres . Ces composés, contrairement aux métaux, ne sont pas de bons conducteurs d’électricité et de chaleur, ni brillants.
L’oxygène, le carbone, l’hydrogène, l’azote, le phosphore et le soufre, qui sont les éléments fondamentaux de la vie , font partie des non-métaux. Ces éléments non métalliques peuvent être solides, liquides ou gazeux.
Ils sont principalement classés comme suit :
- Halogènes. Fluor (F), chlore (Cl), brome (Br), iode (I), astatine (At) et tension (Ts).
- gaz nobles . Hélium (He), néon (Ne), argon (Ar), krypton (Kr), xénon (Xe), radon (Rn), oganesson (Og).
- Autres non-métaux. Hydrogène (H), carbone (C), soufre (S), sélénium (Se), azote (N), oxygène (O) et phosphore (P).
More in: Non-métaux