Nous expliquons ce qu’est un composé chimique, quels types existent et la composition chimique de l’eau. En outre, les éléments chimiques.

Qu’est-ce qu’un composé chimique ?
Un composé chimique est toute substance formée par l’union de deux ou plusieurs types d’éléments chimiques , c’est-à-dire par des atomes de deux ou plusieurs types différents d’ éléments chimiques , reliés entre eux par des liaisons chimiques quelconques.
Un composé chimique ne peut pas être séparé en ses éléments constitutifs par des méthodes physiques ( distillation , décantation , etc.). La seule façon de séparer un composé chimique en ses éléments constitutifs est par des réactions chimiques .
Le niveau de complexité d’un composé chimique peut être très simple ou très complexe, cela dépend du nombre d’ atomes qui le forment et de la manière dont ils sont combinés. Il existe des composés constitués de quelques atomes et des composés constitués de centaines d’atomes liés occupant des positions très spécifiques dans le composé.
Par exemple, les substances binaires telles que le dioxyde de carbone (CO 2 ) ou l’eau (H 2 O) sont des composés chimiques . Il en va de même pour d’autres plus complexes comme l’acide sulfurique (H 2 SO 4 ) ou le glucose (C 6 H 12 O 6 ), voire des macromolécules inexprimables dans une formule chimique simple, comme une molécule d’ADN humain .
Bien qu’ils soient des agglomérations plus ou moins complexes d’éléments, les composés chimiques présentent un ensemble stable de propriétés physiques et chimiques .
D’autre part, un changement apparemment mineur dans la configuration de ses atomes constitutifs peut produire des changements radicaux dans ces propriétés , ou il peut produire des substances entièrement nouvelles par une réaction chimique.
Il peut vous aider : Produit en chimie
Types de composés chimiques
Les composés chimiques peuvent être classés selon deux critères différents, qui sont :
- Selon le type de liaison entre ses atomes. Selon le type de liaison existant entre les éléments constitutifs d’un composé chimique, ils peuvent être classés en :
- molécules . Unis par des liaisons covalentes (partage d’électrons).
- Ions . Unis par des liaisons électromagnétiques et dotés d’une charge positive ou négative.
- Composés intermétalliques. Unis par des liaisons métalliques , qui se produisent évidemment généralement entre des atomes de type métallique.
- Complexes. Ils maintiennent leurs longues structures ensemble par des liaisons covalentes coordonnées (il s’agit d’un type de liaison covalente dans laquelle la paire d’électrons partagée est apportée par un seul des atomes qui participent à cette liaison).
- Selon la nature de sa composition. Selon le type d’atomes qui les intègrent, ils peuvent être classés en :
- Composés organiques. Ce sont ceux qui ont le carbone comme élément de base, autour duquel se structurent les autres atomes. Ce sont les composés fondamentaux de la chimie de la vie . Ils peuvent être:
- Aliphatique. Ce sont des composés organiques qui ne sont pas aromatiques. Ils peuvent être linéaires ou cycliques.
- aromatique. Ce sont des composés organiques formés par des structures à liaisons conjuguées. Cela signifie qu’une liaison double ou triple alterne avec une liaison simple dans toute la structure. Ils sont très stables.
- hétérocyclique. Ce sont des composés organiques dont la structure est cyclique, mais au moins un atome du cycle est un élément autre que le carbone.
- Organométallique. Ce sont des composés organiques dans lesquels un métal fait également partie de leur structure.
- polymères . Ce sont des macromolécules composées de monomères (molécules plus petites).
- Composés inorganiques . Ce sont ceux dont la base n’est pas toujours le carbone. Ils sont de nature très diverse et se produisent dans tous les états d’agrégation . Ceux-ci sont classés en :
- oxydes basiques . Ils se forment lorsqu’un métal réagit avec l’oxygène. Par exemple : oxyde de fer(II) (FeO)
- oxydes acides. Ils sont formés par des liaisons entre l’oxygène et un élément non métallique . Par exemple : oxyde de chlore (VII) (Cl 2 O 7 )
- Hydrocarbures. Ils peuvent être métalliques et non métalliques. Les hydrures métalliques sont formés par l’union d’un anion hydrure (H – ) de charge électrique négative, avec n’importe quel cation métallique (charge positive). Les hydrures non métalliques sont formés par l’union d’un non-métal (qui dans ce cas réagit toujours avec son état d’oxydation le plus bas) et d’hydrogène. Ces derniers sont généralement gazeux et sont nommés en préfixant le nom du non-métal suivi de la phrase -hydrogène. Par exemple : hydrure de lithium (LiH), hydrure de béryllium (BeH 2 ), fluorure d’hydrogène (HF (g) ), chlorure d’hydrogène (HCl (g) ).
- Les hydracides. Ce sont des composés composés d’hydrogène et d’un non-métal. Lorsqu’ils sont dissous dans l’eau, ils donnent des solutions acides. Par exemple : acide fluorhydrique (HF (aq) ), acide chlorhydrique (HCl (aq) ).
- Hydroxydes (ou bases). Ce sont des composés formés par l’union d’un oxyde basique et d’eau . Ils sont reconnus par la fonction hydroxyle -OH. Par exemple : hydroxyde de plomb(II) ( Pb(OH) 2 ), hydroxyde de lithium (LiOH).
- Oxacides. Ce sont des composés également appelés oxoacides ou oxyacides (et communément « acides »). Ce sont des acides qui contiennent de l’oxygène. Ils se forment lorsqu’un oxyde acide et de l’eau réagissent. Par exemple : acide sulfurique (H 2 SO 4 ), acide hyposulfureux (H 2 SO 2 ).
- Vous sortez. Les sels sont le produit de l’union de substances acides et basiques. Ils sont classés en : neutres, acides, basiques et mixtes.
- sels neutres. Ils sont formés par la réaction entre un acide et une base ou un hydroxyde, qui libère de l’eau dans le processus. Ils peuvent être binaires et ternaires selon que l’acide est respectivement un hydracide ou un oxacide. Par exemple : chlorure de sodium (NaCl), trichlorure de fer (FeCl 3 ), phosphate de sodium (Na 3 PO 4 )
- sels acides. Ils se forment par remplacement de l’hydrogène d’un acide par des atomes métalliques. Par exemple : hydrogénosulfate de sodium (VI) (NaHSO4).
- Sels basiques. Ils sont formés en remplaçant les groupes hydroxyle d’une base par les anions d’un acide. Par exemple : dihydroxychlorure de fer (III) (FeCl(OH) 2 ) .
- Sels mélangés. Ils sont produits en remplaçant les hydrogènes d’un acide par des atomes métalliques de différents hydroxydes. Par exemple : tétraoxosulfate de sodium et de potassium (NaKSO4).
- Composés organiques. Ce sont ceux qui ont le carbone comme élément de base, autour duquel se structurent les autres atomes. Ce sont les composés fondamentaux de la chimie de la vie . Ils peuvent être:
Exemples quotidiens de composés chimiques

Il est facile de trouver des exemples quotidiens de composés chimiques. Jetez un œil à la cuisine : les composés chimiques sont l’eau (H 2 O), le sucre ou le saccharose (C 12 H 22 O 11 ), le sel (NaCl), l’huile (glycérol et trois radicaux carboxylates) ou le vinaigre , qui est une dilution d’ acide acétique (C 2 H 4 O 2 ).
La même chose, bien qu’à des niveaux de complexité beaucoup plus élevés, se produit avec le beurre, le fromage, le lait ou le vin .
Éléments chimiques et composés chimiques
Les éléments chimiques sont les différents types d’atomes qui composent la matière et qui se distinguent les uns des autres selon la configuration particulière de leurs particules subatomiques ( protons , neutrons et électrons ).
Les éléments chimiques peuvent être regroupés en fonction de leurs propriétés chimiques , c’est-à-dire des forces auxquelles ils répondent plus ou moins facilement, du comportement qu’ils présentent dans certaines réactions ou d’autres caractéristiques structurelles. Ils sont représentés, classés et organisés dans le tableau périodique des éléments.
Les composés chimiques sont des combinaisons d’éléments chimiques de complexité différente. Les éléments chimiques sont les plus petits morceaux de matière , qui ne peuvent pas être décomposés en plus petits morceaux par des méthodes physiques (il est nécessaire de recourir à des méthodes chimiques pour cela).
Un exemple de composé chimique est l’eau. Ce composé est composé d’hydrogène et d’oxygène. Si la molécule d’eau peut être décomposée, l’oxygène et l’hydrogène purs existent sous leurs formes moléculaires gazeuses O 2 et H 2 .
Composition chimique de l’eau
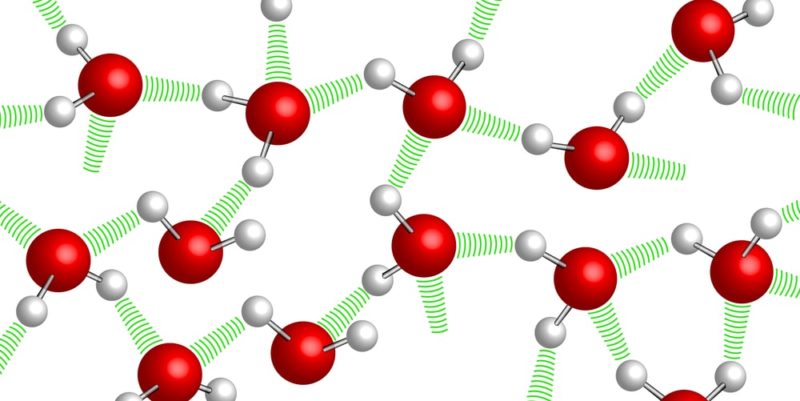
Comme l’indique sa formule chimique (H 2 O), bien qu’étant une substance simple, l’eau est un composé chimique constitué de deux types d’éléments : l’hydrogène (H) et l’oxygène (O) , dans une proportion fixe et déterminée dans chacun des ses molécules : deux atomes d’hydrogène pour chaque atome d’oxygène.
Ces atomes sont liés par des liaisons covalentes, qui confèrent à la molécule une grande stabilité. De plus, ils lui confèrent des propriétés dipolaires qui permettent la formation de ponts entre les atomes d’hydrogène d’une molécule d’eau et les autres (ponts hydrogène).
Continuer avec : Chimie inorganique







