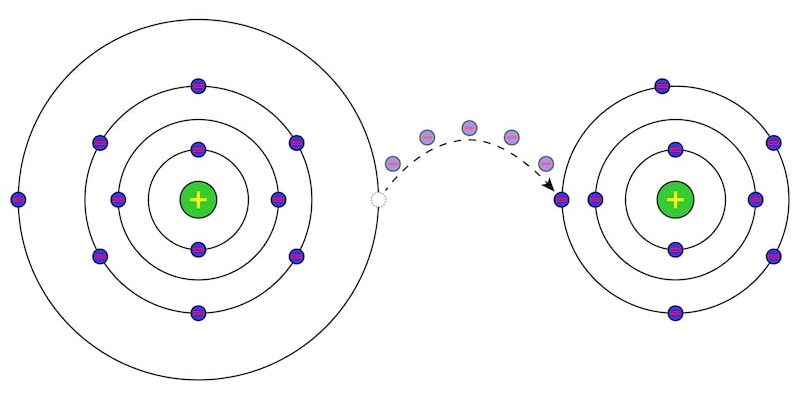
Nous expliquons ce qu’est la chimie inorganique. Aussi, comment les composés inorganiques sont classés et quelques exemples.

Qu’est-ce que la chimie inorganique ?
La chimie inorganique est appelée la branche de la chimie qui concentre son étude sur la formation, la composition, la classification et les réactions chimiques des composés inorganiques , c’est-à-dire ceux dans lesquels les liaisons carbone-hydrogène ne prédominent pas (typique de la chimie organique). ).
La distinction entre chimie organique et chimie inorganique n’est pas toujours aussi visible qu’il n’y paraît, et souvent les deux domaines d’étude se chevauchent ou partagent leur champ de connaissances , comme c’est le cas en chimie organométallique (étude des composés chimiques qui ont au moins une liaison entre un carbone atome appartenant à un composé organique et un atome de métal).
Au départ, on pensait que la différence entre les deux disciplines avait à voir avec une certaine « impulsion vitale » de la chimie organique, puisque c’est celle utilisée pour expliquer l’émergence de la vie , mais cette hypothèse a été écartée car elle l’a été. mieux comprendre.
D’autre part, dans le passé, les substances composées de carbone qui étaient extraites de plantes et d’ animaux étaient classées comme « organiques » . Alors que les substances extraites des pierres et minéraux étaient dites « inorganiques » . De nos jours, avec les progrès scientifiques et technologiques, il est possible de synthétiser des substances organiques, par exemple le fullerène et le graphène, dans les laboratoires de chimie.
La chimie inorganique est largement utilisée en géologie , minéralogie, magnétochimie, géochimie et autres domaines d’application similaires.
Voir aussi: Acide acétique
Classification des composés inorganiques

Les composés inorganiques peuvent être classés selon le nombre d’éléments impliqués dans la formation de chacun d’eux :
- composés binaires . Ce sont ceux qui ne sont composés que de deux éléments chimiques , tels que :
- oxydes. Ce sont des composés formés par l’union de l’oxygène (O 2 ) avec un élément métallique (oxydes basiques) ou un élément non métallique (oxydes acides) du tableau périodique . Les propriétés des oxydes sont très diverses et peuvent être trouvées dans les trois états d’agrégation . Par exemple, certains sont gazeux, comme le dioxyde de carbone (CO 2 ), et d’autres sont solides, comme l’oxyde de magnésium (MgO).
- Peroxydes. Les peroxydes sont formés par l’union du groupe peroxyde (O 2 2- ) avec un élément métallique. Dans ces composés, l’oxygène a un indice d’oxydation de -1. Ils peuvent être inflammables et provoquer des explosions.
- Hydrures. Ils peuvent être métalliques et non métalliques. Les hydrures métalliques sont formés par l’union d’un anion hydrure (H – ) de charge électrique négative, avec n’importe quel cation métallique (charge positive). Les hydrures non métalliques sont formés par l’union d’un non-métal (qui dans ce cas réagit toujours avec son état d’oxydation le plus bas) et d’hydrogène. Dans le cas des hydrures métalliques, ils peuvent avoir des propriétés métalliques telles qu’une bonne conductivité électrique . Ils peuvent être thermiquement instables et provoquer des explosions.
- Acides hydriques ou acides binaires. Ce sont des acides binaires composés d’hydrogène et d’un non-métal autre que l’oxygène. Les acides ont une odeur caractéristique et un goût aigre ou amer. Leur pH est inférieur à 7. Ils sont également de bons conducteurs de l’électricité lorsqu’ils sont en solution aqueuse.
- sels binaires. Ce sont des composés formés par des ensembles d’atomes chargés électriquement, soit des cations (+) ou des anions (-). Ces sels sont composés de deux types d’atomes. A température ambiante, ce sont des solides cristallins avec des températures de fusion et d’ébullition élevées. Ce sont de bons conducteurs de courant électrique en solution aqueuse.
- Composés ternaires . Ce sont ceux dans lesquels trois éléments chimiques interviennent. Comme:
- Hydroxydes. Ce sont des composés résultant de l’union d’un élément métallique avec un groupement hydroxyle (OH – ). Ils sont communément appelés « bases » ou « alcalis ». A température ambiante, ils sont solides et généralement corrosifs. Ils réagissent avec les acides pour produire des sels.
- Oxacides. Ce sont des composés acides qui se forment par la réaction entre un anhydride (un oxyde non métallique) et de l’eau . Sa formule dépend toujours d’un motif HaAbOc, où A est un métal de transition ou un non-métal, et a, b et c sont les indices indiquant la quantité de chaque atome. Ces composés ont des propriétés acides, leur pH est inférieur à 7.
- Sels ternaires. Ce sont des composés formés par des ensembles d’atomes chargés électriquement, soit des cations (+) ou des anions (-). Ces sels sont constitués de seulement trois types d’atomes. Ses propriétés sont équivalentes à celles des sels binaires.
Il peut vous aider : Acides et bases
Exemples de composés inorganiques

Voici quelques exemples courants des composés énumérés ci-dessus :
- Acides binaires ou hydracides. Acide fluorhydrique (HF (aq) ), acide chlorhydrique (HCl (aq) ).
- Oxacides. Acide sulfurique (H 2 SO 4 ), acide carbonique (H 2 CO 3 ), acide sulfureux (H 2 SO 3 ).
- hydrures métalliques . Hydrure de lithium (LiH), hydrure de béryllium (BeH 2 ).
- hydrures non métalliques. Fluorure d’hydrogène (HF (g) ), Chlorure d’hydrogène (HCl (g) ).
- Bases. Hydroxyde de sodium (soude caustique) (NaOH), hydroxyde de magnésium (lait de magnésie) (Mg(OH) 2 ), hypochlorite de sodium (chlore et eau de javel pour piscine) (NaClO), bicarbonate de sodium (NaHCO 3 ).
- oxydes métalliques. Oxyde cuivreux ou oxyde de cuivre (I) (Cu 2 O), oxyde cuivrique ou oxyde de cuivre (II) (CuO), oxyde ferreux ou oxyde de fer (II) (FeO), oxyde de sodium (Na 2 O).
- oxydes non métalliques. Dioxyde de carbone (CO 2 ), monoxyde de carbone (CO), dioxyde de soufre ou dioxyde de soufre (SO 2 ), monoxyde de dibrome ou oxyde de brome (I) (Br 2 O).
- sels binaires. Chlorure de sodium (NaCl), bromure de potassium (KBr), trichlorure de fer ou chlorure de fer (III) (FeCl 3 )
- Sels ternaires. Nitrate de sodium (NaNO 3 ) , phosphate de calcium (Ca 3 (PO 4 ) 2 ), sulfate de sodium (Na 2 SO 4 ).