Nous expliquons ce qu’est la corrosion et quels types de corrosion existent. Exemples et comment l’éviter. De plus, relation entre la corrosion et l’oxydation.

Qu’est-ce que la corrosion ?
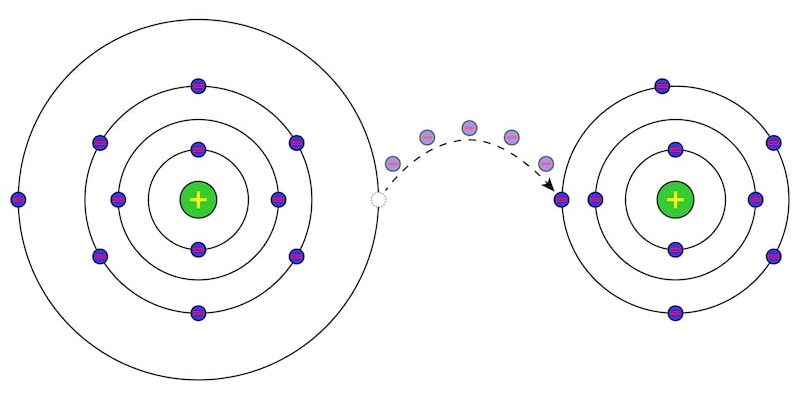
La corrosion est le processus de dégradation de certains matériaux, à la suite d’une réaction électrochimique , c’est-à-dire d’ oxydo-réduction , à partir de leur environnement.
C’est un phénomène naturel et spontané qui touche surtout (mais pas exclusivement) les métaux . La vitesse de la réaction dépend de la température à laquelle elle se produit, ainsi que des propriétés des éléments mis en jeu, notamment leur salinité.
La corrosion est un processus chimique dans lequel trois facteurs interviennent généralement : l’élément corrodé, l’ environnement et, en général, l’eau . Cependant, il existe également des substances corrosives, c’est-à-dire capables de provoquer la corrosion des matériaux avec lesquels elles entrent en contact direct.
De son côté, l’industrie métallurgique étudie la corrosion comme un ennemi important à vaincre par ses produits , notamment ceux exposés à l’environnement, dans les pièces d’architecture ou de construction. En fait, on estime que toutes les quelques secondes, environ cinq tonnes d’acier sont perdues dans le monde à cause de la corrosion.
Voir aussi: Phénomènes chimiques
types de corrosion
D’une manière générale, il existe deux types de corrosion : chimique et électrochimique, selon le type de matériaux et de réactions mis en jeu :
- corrosion chimique. Il se produit lorsqu’un matériau réagit dans un liquide ou un gaz corrosif , jusqu’à ce qu’il se dissolve complètement ou jusqu’à ce que le liquide soit saturé. Cela peut se produire de différentes manières :
- Attaque de métal liquide. Il se produit lorsqu’un métal solide et un métal liquide entrent en contact et que le premier est corrodé à ses points faibles par le second.
- Lessivage sélectif. Elle se produit lorsqu’il y a une corrosion sélective dans les alliages métalliques .
- Attaque chimique. Il se produit avec des réactions chimiques agressives par des solvants puissants , tels que ceux capables de dissoudre les polymères , généralement considérés comme résistants à la corrosion.
- corrosion électrochimique. Il se produit généralement dans les métaux, lorsque leurs atomes perdent des électrons et deviennent des ions . Cela peut se produire de différentes manières :
- Corrosion microbiologique. Lorsqu’elles sont causées par des organismes vivants microscopiques capables de modifier la chimie des matériaux, tels que les bactéries , les algues et les champignons .
- Corrosion galvanique. C’est le plus intense de tous et se produit lorsque différents métaux interagissent les uns avec les autres, et l’un agit comme une anode et l’autre comme une cathode, formant ce qu’on appelle une cellule galvanique.
- Corrosion par aération de surface. Connu sous le nom d’effet Evans, il se produit sur des surfaces planes situées dans des endroits humides et sales, qui favorisent les environnements chargés électronégativement.
Exemples de corrosion au quotidien

Voici quelques exemples de corrosion dans la vie quotidienne :
- Corrosion des conduites d’eau. Il se produit surtout dans ceux en métal, qui ont tendance à se briser avec le temps et à contaminer l’eau avec de petites doses d’oxyde, ce qui lui donne une couleur noirâtre ou brune.
- Rouille sur les métaux exposés à l’eau. Elle se produit sur la tôle de la machine à laver automatique, ou sur les portes des voitures laissées sur la plage, où l’environnement salin accélère la réaction oxydative et des fissures et les typiques taches brunes de rouille apparaissent rapidement.
- La couleur de la Statue de la Liberté. Son ton d’origine ne doit pas être verdâtre, mais cuivre , le matériau à partir duquel il est fabriqué. Étant entouré d’eau, l’ humidité de l’ air l’ oxyde et le recouvre d’une poudre verdâtre (oxyde de cuivre), produit de la corrosion.
- Corrosion des aliments en conserve. Les canettes qui sont restées trop longtemps dans le garde-manger commencent à montrer des taches brunes dans certaines régions , un signe certain que la corrosion aéroportée a commencé à les affecter.
Comment éviter la corrosion ?
La lutte contre la corrosion fait partie des industries métallurgiques, qui disposent de divers mécanismes pour prévenir ou ralentir ces processus de désagrégation des métaux, tels que :
- Revêtements. De nombreux métaux sont recouverts de polymères ou de plastiques , par exemple, pour prévenir ou minimiser la corrosion environnementale, en les isolant de leur environnement dans une substance plus résistante à ces types de réactions.
- Alliages . De nombreuses combinaisons de métaux donnent au résultat une plus grande résistance à la corrosion, comme c’est le cas avec les aciers alliés au zinc.
- Inhibiteurs de corrosion. Ce sont des substances chimiques qui ont la propriété de ralentir ou d’empêcher le processus naturel de corrosion de certains matériaux, il suffit donc de les immerger dans un film de celles-ci pour les rendre plus résistants.
- Choix des matériaux. La solution la plus simple consiste à choisir avec soin les matériaux à laisser exposés à l’environnement et ceux à ne pas utiliser, et ceux à utiliser pour les ouvrages exposés aux intempéries ou à l’action de l’eau, par exemple.
corrosion et oxydation
Bien qu’elle ne soit pas souvent appelée ainsi, l’oxydation est une réaction de corrosion puisqu’un échange électronique se produit dans chaque acte d’oxydation, classable comme corrosion électrochimique.
Pour cette raison, les métaux laissés à l’extérieur ou immergés dans l’eau se corrodent , car ils réagissent avec l’oxygène de l’air ou de l’eau et forment des couches d’oxyde à leur surface, qui empêchent la réaction chimique d’ avancer.
Cependant, cette couche d’oxyde est éliminée mécaniquement et les couches plus profondes du métal sont à nouveau exposées à l’oxygène, entraînant la destruction complète du matériau. Ce processus est particulièrement rapide dans les environnements salins, car le chlorure de sodium agit comme un catalyseur de la réaction, l’accélérant.
Plus dans: Oxydation