Nous expliquons ce qu’est la combustion, comment elle se produit et quelles sont les étapes de la réaction. Aussi, classification et exemples.
Qu’est-ce que la combustion ?
La combustion est un type de réaction chimique exothermique . Il peut s’agir de matière à l’état gazeux ou à l’état hétérogène (liquide-gaz ou solide-gaz). Il génère de la lumière et de la chaleur dans la plupart des cas, et il est produit très rapidement.
Traditionnellement, la combustion est comprise comme un processus d’ oxydation rapide de certains éléments combustibles , c’est-à-dire constitués principalement d’hydrogène, de carbone et parfois de soufre. De plus, elle se déroule nécessairement en présence d’oxygène.
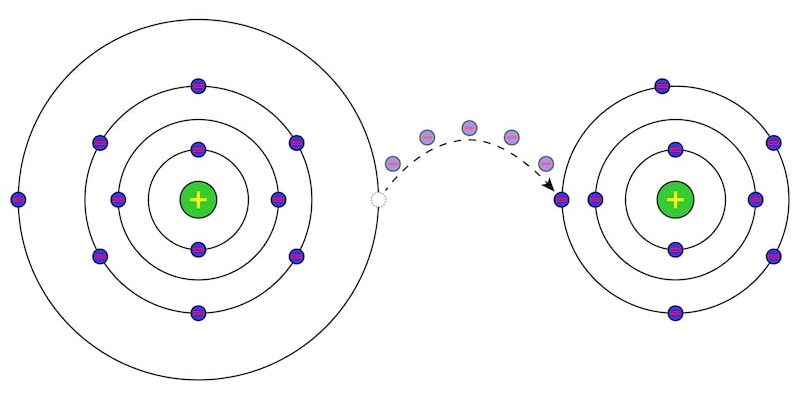
En réalité, les combustions sont des réactions redox (réduction-oxydation) qui peuvent se produire aussi bien de manière contrôlée, comme dans les moteurs à combustion interne, qu’incontrôlée, comme dans les explosions. Ces réactions impliquent un échange d’ électrons entre les atomes de matière au cours de la réaction.
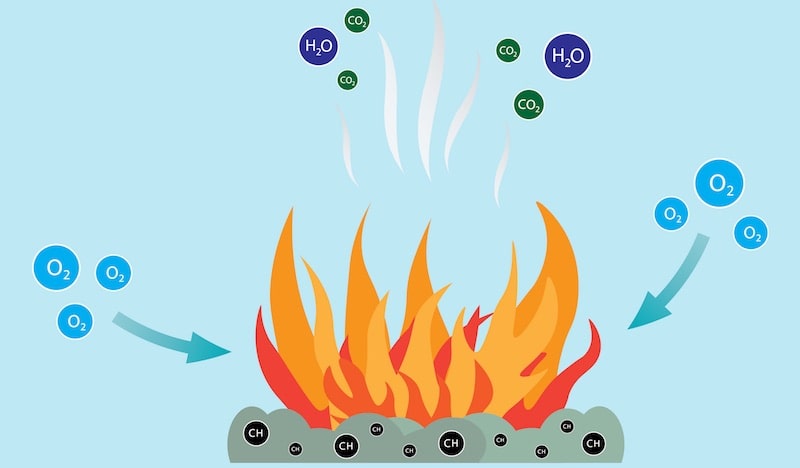
Presque toujours, la combustion génère de l’énergie thermique et lumineuse et produit également d’autres substances gazeuses et solides, telles que le dioxyde de carbone (CO 2 ) et la vapeur d’eau , ou des résidus solides du combustible (la substance consommée dans la réaction) et du comburant (le substance qui favorise la réaction). Les substances générées dépendent de la nature chimique des réactifs impliqués dans la combustion.
De cette manière, bien que dans l’image traditionnelle de la combustion, il y ait toujours du feu, il est possible que le feu ne soit pas généré, car il ne s’agit que d’une forme de plasma (gaz ionisé) produit par le dégagement de chaleur de la réaction chimique de combustion, dont la formation dépend des conditions et des réactifs de chaque réaction spécifique.
Voir aussi : Enthalpie
Comment se produit la combustion ?
Les combustions sont un type de réaction redox , c’est-à-dire une réaction de réduction-oxydation. Cela signifie qu’en eux, un réactif est oxydé (perd des électrons), tandis que l’autre est réduit (gagne des électrons).
Dans le cas de la combustion, l’agent oxydant (oxygène) obtient des électrons de l’agent réducteur (combustible) ou, ce qui revient au même, l’oxydant (oxygène) obtient des électrons du combustible. Celle-ci est généralement donnée selon la formule suivante :
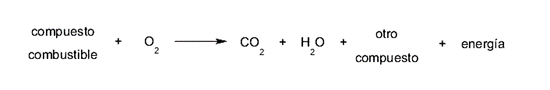
Les composés combustibles peuvent varier dans chaque réaction de combustion, en fonction de leur nature, ainsi que des niveaux d’ énergie générés. Mais le dioxyde de carbone et l’eau sont produits d’une manière ou d’une autre dans toute combustion.
Types de combustion
Il existe trois types de combustion :
- Combustions complètes ou parfaites. Il s’agit des réactions au cours desquelles le matériau combustible est complètement oxydé (consommé) et d’autres composés oxygénés sont produits, tels que le dioxyde de carbone (CO 2 ) ou le dioxyde de soufre (SO 2 ), selon le cas, et de l’eau (H 2 OR ).
- Combustion stoechiométrique ou neutre. C’est le nom donné aux combustions complètes idéales, qui utilisent les bonnes quantités d’oxygène pour leur réaction et qui ne se produisent généralement que dans l’ environnement contrôlé d’un laboratoire.
- combustion incomplète. Ce sont ces réactions dans lesquelles des composés qui n’ont pas été complètement oxydés (également appelés imbrûlés) apparaissent dans les gaz de combustion. Ces composés peuvent être du monoxyde de carbone (CO), de l’hydrogène, des particules de carbone, etc.
réaction de combustion
Les processus de combustion comprennent en fait un ensemble de réactions chimiques rapides qui se produisent simultanément. Chacune de ces réactions peut être appelée une étape ou une phase. Les trois étapes fondamentales de la combustion sont :
- Pré-réaction ou première étape. Les hydrocarbures présents dans le matériau combustible se décomposent et commencent leur réaction avec l’oxygène de l’ air en formant des radicaux (composés moléculairement instables). Cela déclenche une réaction en chaîne d’apparition et de disparition de composés chimiques où, généralement, plus de composés sont formés qu’ils ne sont décomposés.
- Oxydation ou seconde étape. La majeure partie de l’énergie thermique de la réaction est générée dans cette étape. Lorsque l’oxygène réagit avec les radicaux de l’étape précédente, un violent processus de déplacement d’ électrons est généré . Dans le cas d’explosions, un nombre élevé de radicaux entraîne une réaction massive et violente.
- Fin de la réaction ou troisième étape. Cela se produit lorsque l’oxydation des radicaux est terminée et que des molécules stables se forment qui seront les produits de la combustion.
exemples de combustion

Voici quelques exemples simples de combustion dans la vie de tous les jours :
- L’éclairage d’un match/match. C’est le cas le plus emblématique de la combustion. Lorsque la tête d’allumette (revêtement phosphore-soufre) est grattée contre une surface rugueuse, elle s’échauffe par frottement et déclenche une combustion rapide, qui à son tour produit une flamme courte.
- L’allumage d’une cuisinière à gaz. Les réchauds domestiques fonctionnent en brûlant un gaz d’hydrocarbure, généralement un mélange de propane (C 3 H 8 ) et de butane (C 4 H 10 ), que l’appareil extrait d’un tuyau ou d’un récipient. Mis en contact avec l’air et muni d’une charge initiale d’énergie calorifique (telle qu’une veilleuse, ou une allumette), le gaz commence sa réaction ; mais pour maintenir la flamme allumée, le carburant doit être fourni en permanence.
- Bases fortes et matières organiques . La plupart des bases fortes (hydroxydes) telles que la soude caustique, la potasse caustique et d’autres substances à pH basique extrême , génèrent de violentes réactions d’oxydation au contact de la matière organique . Cela signifie que nous pouvons nous brûler au contact de ces substances et même déclencher des incendies avec elles, car ces réactions sont généralement très exothermiques.
- Moteurs à combustion interne. Ces artefacts sont présents dans les voitures, les bateaux et autres véhicules fonctionnant aux combustibles fossiles tels que le diesel, l’essence ou le kérosène. Ils sont un exemple de l’utilisation de la combustion contrôlée. En eux, les hydrocarbures du carburant sont consommés et de petites explosions sont générées qui, à l’intérieur du système de piston, se transforment en mouvement , produisant également des gaz polluants, qui sont rejetés dans l’ atmosphère .
Continuer avec : Réactions endothermiques