Nous expliquons ce qu’est un changement chimique et quelles sont ses caractéristiques. Aussi, des exemples et des différences avec un changement physique.

Qu’est-ce qu’un changement chimique?
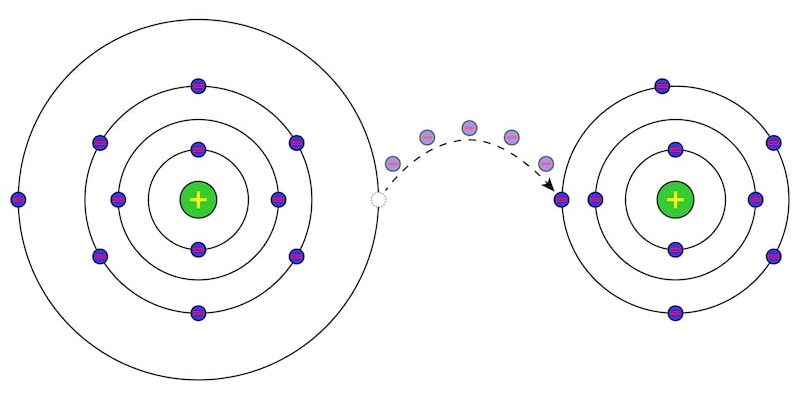
Les changements chimiques sont un type d’ altération de la matière qui modifie sa constitution chimique , c’est-à-dire qui altère sa nature et pas seulement sa forme. Cela signifie que les changements chimiques, également appelés réactions chimiques ou phénomènes chimiques , impliquent la rupture et la formation des liaisons chimiques de substances ou de composés chimiques pour former de nouvelles substances ou composés.
Les réactions chimiques se produisent lorsque deux substances ou plus (appelées réactifs ou réactifs) sont chimiquement combinées, ce qui modifie leur structure chimique au cours du processus et peut consommer ( réactions endothermiques ) ou libérer ( réactions exothermiques ) de l’énergie, pour générer deux ou plusieurs nouvelles substances (appelées des produits). Certaines réactions chimiques sont dangereuses pour l’homme , car elles peuvent impliquer ou produire des composés toxiques ou corrosifs. D’autres réactions, telles que certaines réactions exothermiques, peuvent provoquer des explosions.
Dans l’ industrie chimique , de nombreux matériaux que nous utilisons au quotidien sont produits par des réactions chimiques contrôlées. Certaines réactions se produisent spontanément et d’autres doivent être générées par l’homme dans des installations industrielles ou des laboratoires de chimie.
Les réactions chimiques nécessitent un temps stipulé pour se produire, qui varie en fonction de la nature des réactifs et des conditions dans lesquelles la réaction se produit.
Ainsi, les facteurs qui affectent la vitesse des réactions chimiques sont généralement :
- hausse de température. L’augmentation de la température tend à augmenter la vitesse des réactions chimiques.
- Augmentation de la pression. L’augmentation de la pression augmente généralement la vitesse des réactions chimiques. Cela se produit généralement lorsque des substances sensibles aux variations de pression , comme les gaz , réagissent . Dans le cas des liquides et des solides , les changements de pression ne provoquent pas de changements importants dans la vitesse de leurs réactions.
- Etat d’agrégation dans lequel se trouvent les réactifs. Les solides ont tendance à réagir plus lentement que les liquides ou les gaz, bien que la vitesse dépende également de la réactivité de chaque substance.
- Utilisation de catalyseurs. Ce sont des substances qui sont utilisées pour augmenter la vitesse des réactions chimiques. Ces substances n’interviennent pas dans les réactions, elles contrôlent uniquement la vitesse à laquelle elles se produisent. Il existe également des substances appelées inhibiteurs, qui sont utilisées de la même manière mais qui ont l’effet inverse, c’est-à-dire qu’elles ralentissent les réactions.
- Énergie lumineuse (Lumière). Certaines réactions chimiques sont accélérées lorsque la lumière les éclaire.
- Concentration des réactifs. La plupart des réactions chimiques se produisent plus rapidement si elles ont une concentration élevée de leurs réactifs.
Voir aussi : Produit en chimie
exemples de changement chimique

Toute réaction chimique est un exemple parfait d’un changement chimique, même ceux qui ont lieu dans notre corps. Quelques exemples sont:
- Le souffle . Il s’agit d’un processus biologique de changement chimique, dans lequel l’oxygène est prélevé dans l’ air et utilisé pour réagir avec le glucose que nous obtenons des aliments , générant des niveaux élevés d’ énergie chimique ( ATP ) et des quantités de dioxyde de carbone (CO2) provenant des déchets, qui doit être expulsé du corps .
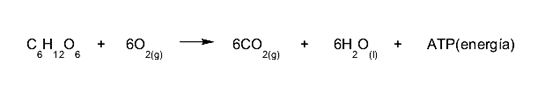
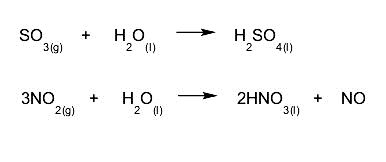
- Les pluies acides . Il se produit dans des environnements où l’ atmosphère est fortement polluée. C’est généralement le résultat de changements chimiques qui se produisent entre l’eau stockée dans les nuages et d’autres gaz dispersés dans l’air, dont la teneur en oxyde de soufre ou en oxyde d’azote génère de l’acide sulfurique ou de l’acide nitrique qui tombe avec la pluie.
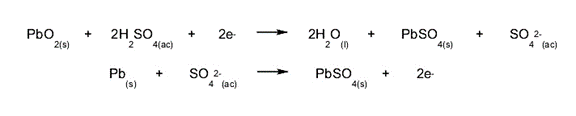
- La formation de sels. La réaction qui se produit à l’intérieur des batteries se produit entre un acide et un métal . Par exemple, les batteries qui utilisent du plomb et de l’acide sulfurique produisent du sulfate de plomb(II), un sel blanc .
- La décomposition de l’ozone. La molécule d’ozone est décomposée en molécules d’oxygène sous l’action d’un certain type de lumière .
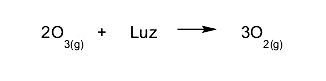
changement chimique et changement physique

Les changements physiques de la matière n’altèrent pas sa composition , c’est-à-dire qu’ils ne modifient pas la structure chimique des substances, de sorte qu’au moyen d’un changement physique, les substances ne peuvent être décomposées ou formées. Les changements physiques ne modifient que les propriétés physiques des substances telles que la forme, la densité et les états d’agrégation (solide, liquide, gaz). D’autre part, les changements physiques sont généralement réversibles, car ils modifient la forme ou l’état de la matière , mais pas sa composition.
Par exemple, en faisant bouillir de l’eau, nous pouvons transformer un liquide en gaz, mais la vapeur résultante est toujours composée de molécules d’eau. Au contraire, si nous congelons de l’eau , elle devient solide, mais c’est toujours chimiquement la même substance. Un autre exemple est le gaz liquéfié que nous utilisons dans nos briquets, qui est généralement du butane (C 4 H 10 ) ou du propane (C 3 H 8 ) transformé à l’état liquide en appliquant une haute pression, mais sans altérer sa composition chimique.
Les changements chimiques modifient la distribution et les liaisons des atomes de matière , les faisant se combiner différemment, obtenant ainsi des substances différentes des premières. Lorsqu’un changement chimique se produit, vous obtenez toujours la même quantité de matière que vous aviez au début, même si c’est dans des proportions différentes , car la matière ne peut pas être créée ou détruite, seulement transformée.
Par exemple, si nous faisons réagir de l’eau (H 2 O) et du potassium (K), nous obtiendrons deux nouvelles substances : l’hydroxyde de potassium (KOH) et l’hydrogène (H 2 ). C’est une réaction qui libère normalement beaucoup d’énergie, elle est donc très dangereuse.
More in: Changement physique